 Technologie-Peripheriegeräte
Technologie-Peripheriegeräte
 KI
KI
 Shi Yigong und andere Teams erscheinen auf dem Cover von Science: KI und Kryo-Elektronenmikroskopie enthüllen die NPC-Struktur auf „atomarer Ebene', ein Durchbruch in den Biowissenschaften
Shi Yigong und andere Teams erscheinen auf dem Cover von Science: KI und Kryo-Elektronenmikroskopie enthüllen die NPC-Struktur auf „atomarer Ebene', ein Durchbruch in den Biowissenschaften
Shi Yigong und andere Teams erscheinen auf dem Cover von Science: KI und Kryo-Elektronenmikroskopie enthüllen die NPC-Struktur auf „atomarer Ebene', ein Durchbruch in den Biowissenschaften
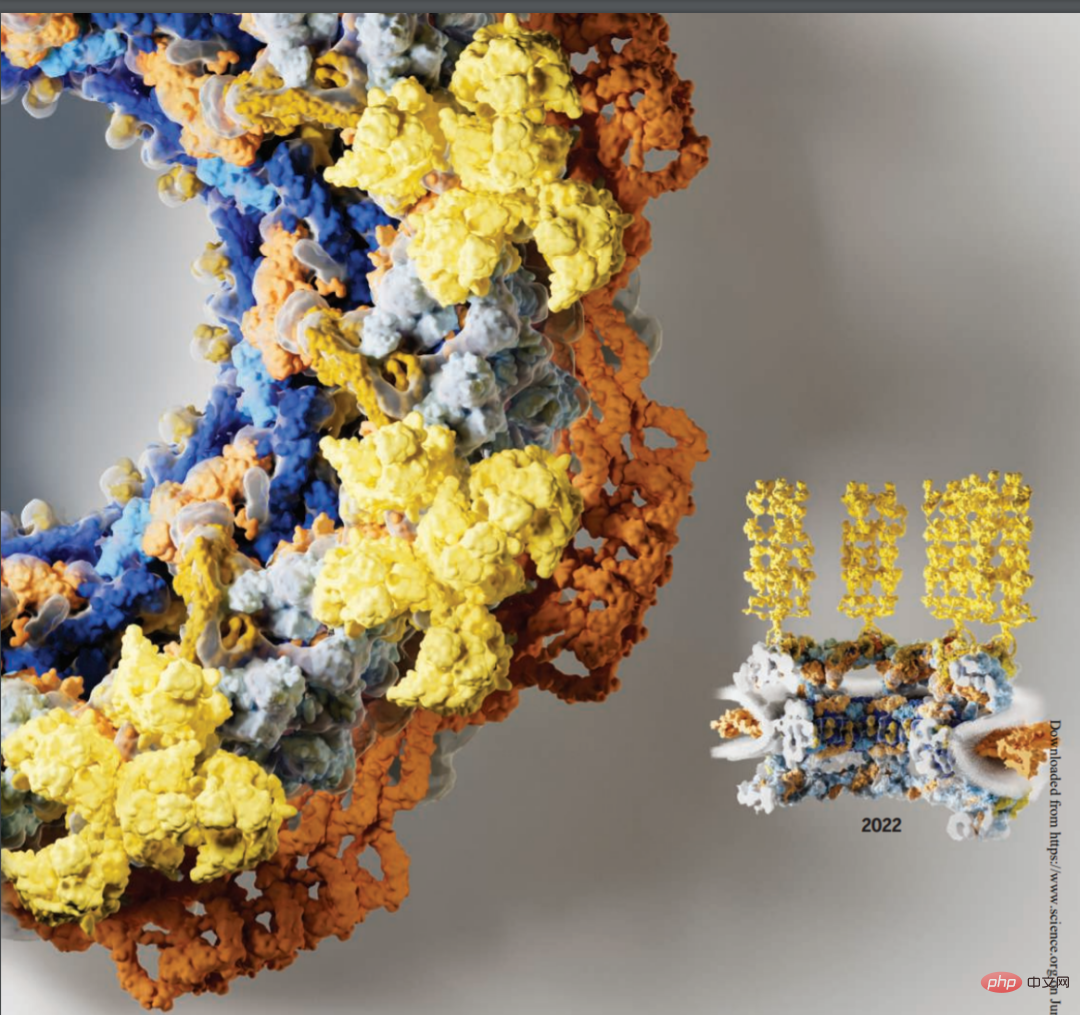
Bevor wir mit dem Text beginnen, werfen wir einen Blick auf ein Bild. Im Bild unten ist es offensichtlich, dass die rechte Bildhälfte umfangreichere Informationen und eine klarere Struktur darstellt. Die linke Hälfte des Bildes von 2016 hat eine relativ einfache Struktur und stellt weniger Informationen dar:

Tatsächlich ist das, was oben gezeigt wird, ein Bild des Nuclear Pore Complex (NPC). Der aus etwa 1.000 Proteinuntereinheiten bestehende Kernporenkomplex ist für den geschäftigen Transport von Makromolekülen zwischen Zellkern und Zytoplasma eukaryotischer Zellen verantwortlich. Er ist auch der einzige wechselseitige Kanal, der Zytoplasma und Zellkern verbindet. Zusätzlich zur Koordination des Transports organisieren NPCs wesentliche Lebensereignisse wie Transkription, mRNA-Reifung, Spleißosomen- und Ribosomenassemblierung. Die wichtige Rolle von NPC ist zu einem Schlüsselpunkt bei Krankheitsmutationen und Wirt-Pathogen-Interaktionen geworden.
Dank der Entwicklung der Technologie zur vollständigen Kernporenstruktur mit niedriger Auflösung und zur Strukturtechnologie für hochauflösende Kernporenkomponenten haben Zellkernporen immer mehr Aufmerksamkeit erhalten. Es war jedoch eine schwierige Herausforderung, diese Informationen zu nutzen, um mehr als 30 verschiedene Proteinkopien korrekt zusammenzusetzen und hochauflösende dreidimensionale Strukturen zu konstruieren.
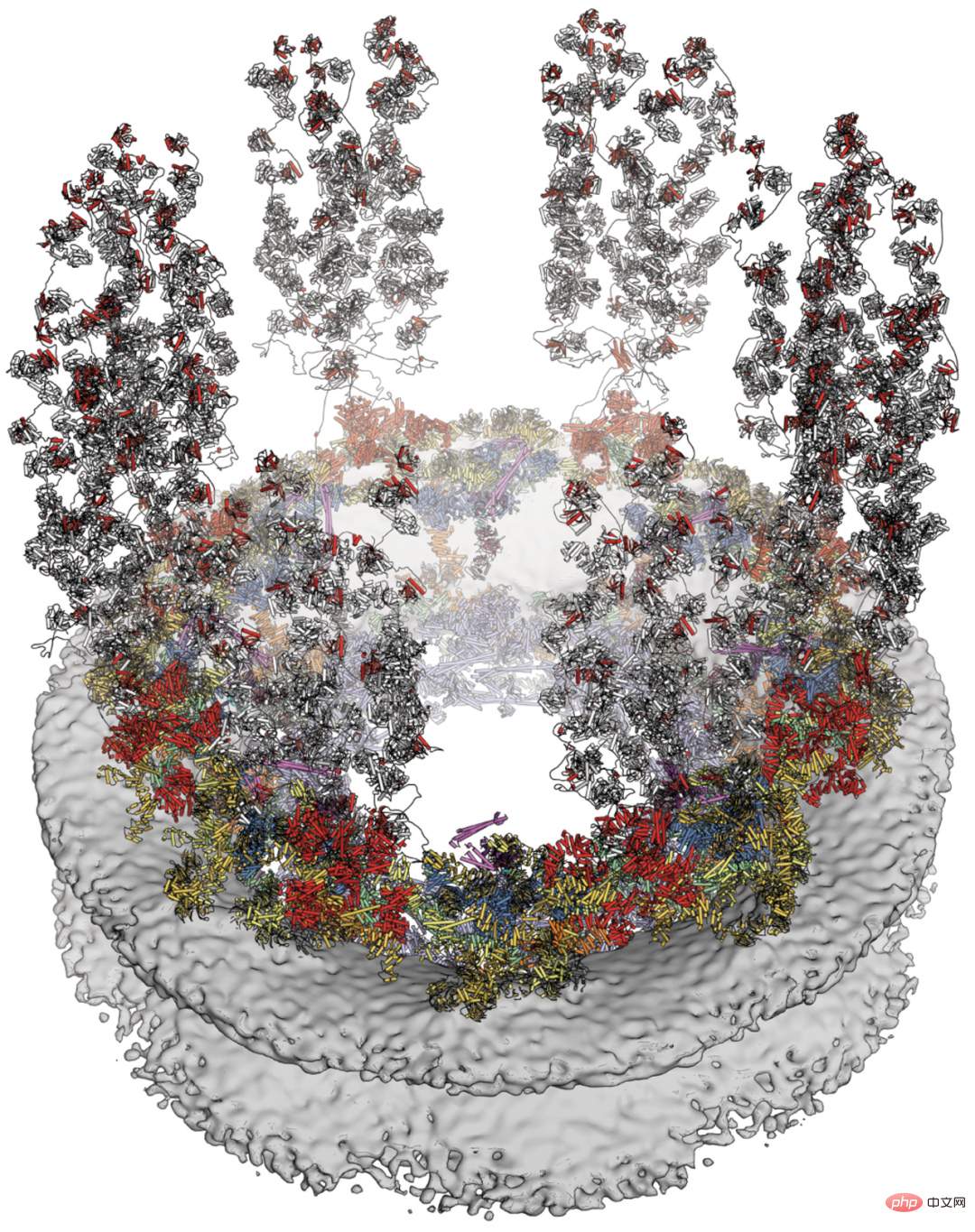
Heute veröffentlichte das Magazin „Science“ fünf Artikel als Titelbeiträge, von denen drei gemeinsam die Struktur des menschlichen Kernporenkomplexes durch Kryo-Elektronenmikroskopie mit nahezu atomarer Auflösung enthüllten, und die anderen beiden Studien durch Xenopus laevis Einzelpartikel Kryo-EM-Bilder des Kernporenkomplexes von Wirbeltieren werden präsentiert. Dieser Titelartikel fügt mehrere Forschungsergebnisse zusammen, um ein Bild menschlicher NPCs auf nahezu atomarer Ebene zu erstellen.

Papieradresse: https://www.science.org/doi/pdf/10.1126/science.add2210
Dieses Forschungsergebnis basiert auf mehreren Studien, darunter mehreren zehn Jahren unter anderem biochemische Rekonstruktion, Röntgenkristallographie, Massenspektrometrie, Mutagenese und Zellbiologie. Menschliche NPCs wurden mithilfe einer stark verbesserten Kryo-Elektronentomographie rekonstruiert und Komponenten mithilfe von Techniken der künstlichen Intelligenz genau modelliert. Es gibt andere Studien, die die Auflösung von Einzelpartikel-Kryo-EM verbessert haben und die Visualisierung von Sekundärstrukturelementen und Details auf Rückstandsebene von Wirbeltier-NPCs ermöglichen. Der molekulare Aufbau bereichert unser Verständnis der Architektur von Wirbeltier- und menschlichen NPCs – vom alten Kerngerüst bis zu den Connexinen, die die Teile zusammenhalten, und von der Kernmembranverankerung an den zytoplasmatischen Filamenten über dem zentralen Transportkanal.
Die hier berichteten Forschungsergebnisse stellen eine Win-Win-Kooperation zwischen experimenteller Strukturbiologie und künstlicher Intelligenz dar und sind ein weiterer Sieg für die Menschheit bei der Erforschung der biologischen, mikroskopischen Welt. Darüber hinaus zeigt es auch, dass die anhaltende Revolution in der Auflösung unersetzlich ist, wenn es darum geht, die Prinzipien der Konstruktion und des Designs makromolekularer Anordnungen zu verstehen.
Nachfolgend finden Sie eine Querschnittsansicht des menschlichen Kernporenkomplexes im Jahr 2022 mit neu aufgelösten Komponenten, einschließlich des symmetrischen Kerns (orange) und der zytoplasmatischen Filamente (gelb):
Fünf Forschungsarbeiten
Papier 1: „Architektur der zytoplasmatischen Fläche der Kernpore“

Papieradresse: https://www.science.org/doi/10.1126/science.abm9129
Nuklear Der Porenkomplex (NPC) ist der einzige bidirektionale Kanal für den nukleozytoplasmatischen Transport. Trotz jüngster Fortschritte bei der Aufklärung der symmetrischen Kernstruktur des NPC bleibt die asymmetrisch verteilte zytoplasmatische Oberfläche, die ein Hotspot für den mRNA-Export und Nukleoporin-bedingte Krankheiten darstellt, weiterhin unerforscht.
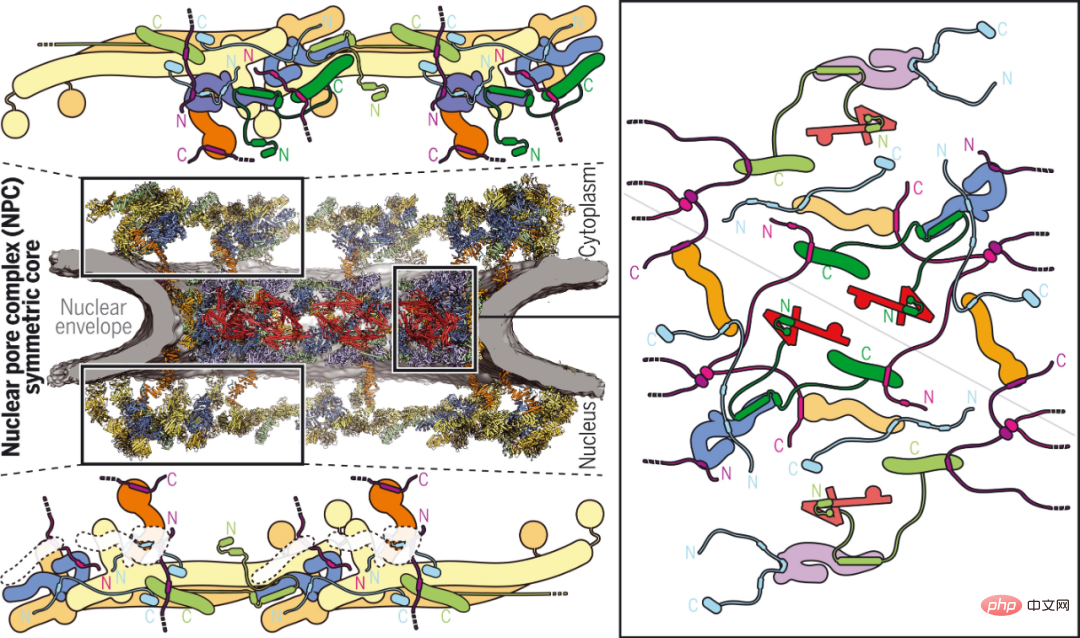
Forscher des California Institute of Technology und anderer Institutionen berichten über die zusammengesetzte Struktur der menschlichen Zytoplasmaoberfläche, die durch die Kombination von biochemischer Rekonstruktion, Kristallstrukturbestimmung, Kryo-Elektronentomographie-Rekonstruktion und physiologischer Überprüfung erhalten wurde. Während artspezifische Motive einen evolutionär konservierten, ~540 Kilodalton heterohexameren zytoplasmatischen Filament-Nucleoporin-Komplex über dem zentralen Transportkanal verankern, hängt die Anbindung des pentameren NUP358-Bündels von der bizyklischen Anordnung im Hüll-Nucleoporin-Komplex ab. Die komplexen Strukturen, die sie aufdecken, und ihre Vorhersagekraft bieten eine reichhaltige Grundlage für die Aufklärung der molekularen Grundlagen des mRNA-Exports und von Nukleoporin-Erkrankungen.
Zytoplasmatisches Gesicht eines menschlichen NPC.
Papier 2: „Architektur des Linker-Gerüsts in der Kernpore“

Papieradresse: https://www.science.org/doi/10.1126/science .abm9798
Während man die Anordnung strukturierter Gerüstnukleoporine im symmetrischen Kern von NPCs bestimmen konnte, bleibt ihr Zusammenhalt durch multivalente unstrukturierte Linker-Nukleoporine unklar.
Durch die Kombination von biochemischer Rekonstruktion, hochauflösender Strukturbestimmung, Kryo-Elektronentomographie-Rekonstruktion und physiologischer Validierung klären Caltech-Forscher die evolutionär konservierte Linker-Gerüststruktur auf, die etwa 64 Megadalen des menschlichen NPC A-nahatomaren Verbundstrukturkerns erzeugt mit Megadalton-Symmetrie. Während Gelenke typischerweise eine starre Rolle spielen, bietet das Gelenkgerüst des NPC die notwendige Plastizität und Robustheit für die reversible Kontraktion und Erweiterung seiner zentralen Transportkanäle und die Entstehung lateraler Kanäle. Ihre Ergebnisse treiben die strukturelle Charakterisierung des NPC-Symmetriekerns erheblich voran und legen den Grundstein für zukünftige Funktionsstudien.
Gelenkhalterungsstruktur für den menschlichen NPC-Symmetriekern.
Papier 3: „KI-basierte Strukturvorhersage ermöglicht integrative Analyse menschlicher Kernporen“

Papieradresse: https://www.science.org/doi / 10.1126/science.abm9506
Obwohl Kernporenkomplexe (NPCs) den nukleozytoplasmatischen Transport vermitteln, ist ihre komplexe 120-Megadalton-Architektur noch immer unvollständig verstanden. Forscher am Max-Planck-Institut für Biophysik und anderen berichten über ein 70-Megadalton-Modell eines menschlichen NPC-Gerüsts mit expliziten Membranen und mehreren Konformationszuständen.
Sie kombinieren KI-basierte Strukturvorhersagen mit In-situ- und zellulärer Kryo-Elektronentomographie sowie umfassender Modellierung. Die Ergebnisse zeigen, dass Linker-Nukleoporine Gerüste innerhalb und zwischen Subkomplexen organisieren, um Strukturen höherer Ordnung aufzubauen. Mikrosekundenlange Molekulardynamiksimulationen zeigen, dass das Gerüst nicht zur Stabilisierung der Verschmelzung der inneren und äußeren Kernmembranen erforderlich ist, sondern vielmehr zur Vergrößerung der zentralen Pore. Sie veranschaulichen, wie KI-basierte Modellierung mit In-situ-Strukturbiologie kombiniert werden kann, um subzelluläre Strukturen über alle Ebenen der räumlichen Organisation hinweg zu verstehen.
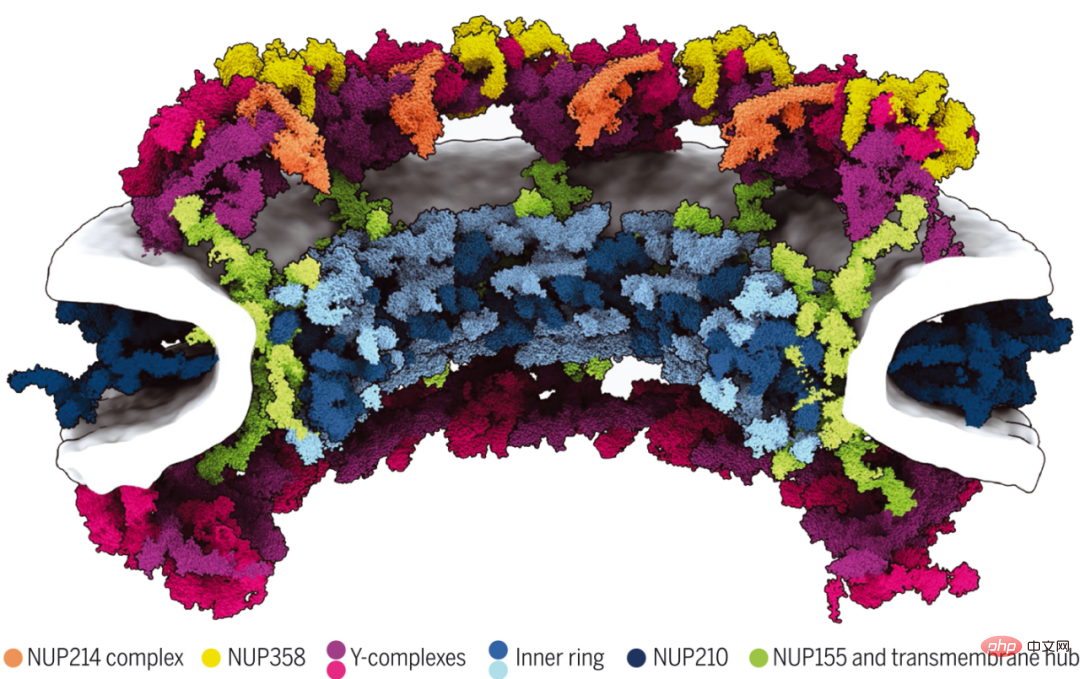
70-Megadalton-Modell der menschlichen NPC-Gerüstarchitektur.
Aufsatz 4: „Struktur des zytoplasmatischen Rings des Kernporenkomplexes von Xenopus laevis“

Papieradresse: https://www.science.org/doi/10.1126/science.abl8280
Westlake University und Tsinghua University analysierten Xenopus laevis NPC mit einer Auflösung von 3,7-4,7 Angström (Angström) Single -Teilchen-Kryo-Elektronenmikroskop-Rekonstruktion der Untereinheit des zytoplasmatischen Rings. Davon wurde die Struktur der Amino-terminalen Domäne von Nup358 auf 3,0 Å aufgelöst, was die Identifizierung von fünf Nup358-Molekülen in jeder Untereinheit des zytoplasmatischen Rings erleichterte.
Das endgültige Modell der Untereinheit des zytoplasmatischen Rings der Forscher umfasst fünf Nup358-, zwei Nup205- und zwei Nup93-Moleküle sowie zwei zuvor charakterisierte Y-Komplexe. Das carboxylterminale Fragment von Nup160 dient als Organisationszentrum für die Spitze jedes Y-Komplexes. Die Strukturanalyse zeigt, wie Nup93, Nup205 und Nup358 den Aufbau eines zytoplasmatischen Ringgerüsts fördern und verbessern, das hauptsächlich aus zwei Schichten von Y-Komplexen besteht.
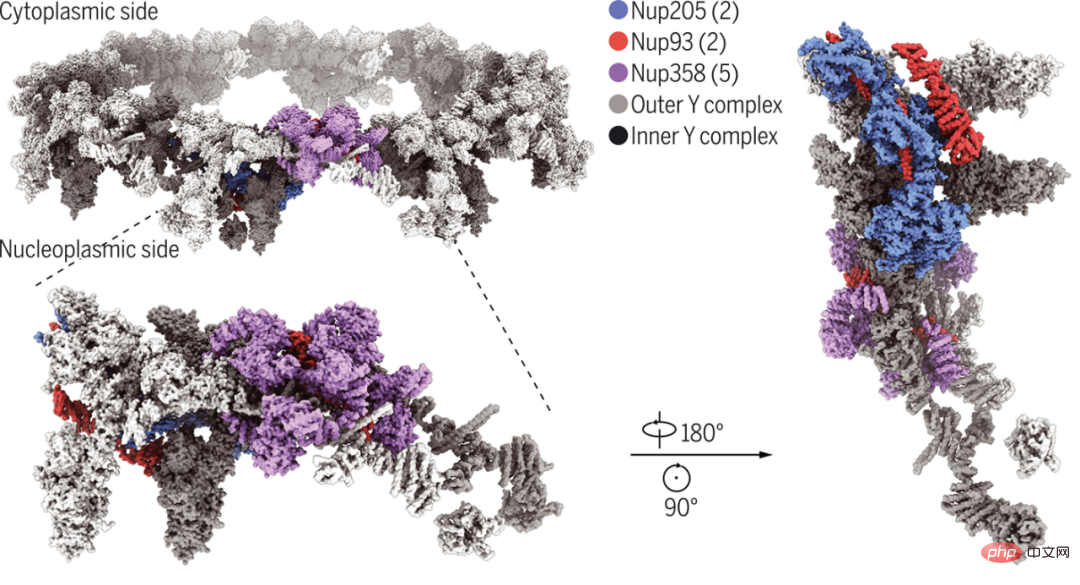
Kryo-EM-Struktur des Xenopus laevis NPC-Doppelschicht-Zytoplasmarings.
Papier 5: „Struktur des zytoplasmatischen Rings des Kernporenkomplexes durch integrative Kryo-EM und AlphaFold“

Papieradresse: https://www.science.org /doi/10.1126/science.abm9326
Forscher der Harvard Medical School und anderer Institutionen nutzten Einzelpartikel-Kryoelektronenmikroskopie und AlphaFold-Vorhersage, um eine nahezu vollständige NPC-Zytoplasma-Ringstruktur aus Xenopus laevis-Oozyten zu bestimmen. Konkret nutzten sie AlphaFold, um die Struktur von Nukleoporinen vorherzusagen und die Karte mit mittlerer Auflösung anzupassen, wobei sie die prominente Sekundärstrukturdichte als Orientierungshilfe nutzten.
Darüber hinaus wurden bestimmte molekulare Wechselwirkungen durch komplexe Vorhersagen mit AlphaFold weiter nachgewiesen oder bestätigt. Die Forscher identifizierten fünf Bindungsmodi für Nup358, die größte NPC-Untereinheit mit Phe-Gly-Wiederholungen für den Transport. Sie sagten voraus, dass Nup358 eine Coiled-Coil-Domäne enthält, die Aktivität bereitstellt und dabei hilft, unter bestimmten Bedingungen als Keimbildungszentrum für die NPC-Bildung zu dienen.
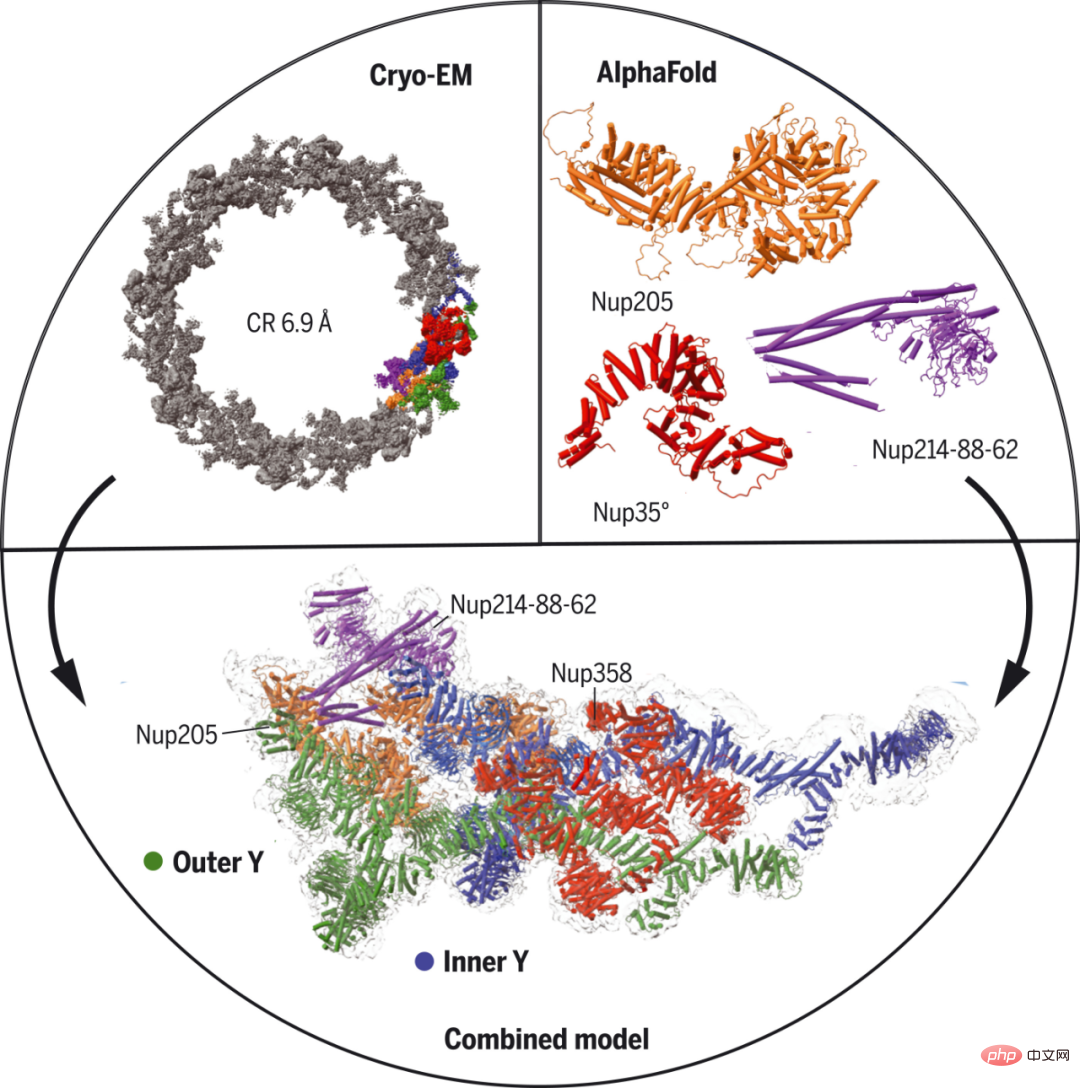
Kryo-EM-Struktur des zytoplasmatischen Rings von Xenopus NPC.
Das obige ist der detaillierte Inhalt vonShi Yigong und andere Teams erscheinen auf dem Cover von Science: KI und Kryo-Elektronenmikroskopie enthüllen die NPC-Struktur auf „atomarer Ebene', ein Durchbruch in den Biowissenschaften. Für weitere Informationen folgen Sie bitte anderen verwandten Artikeln auf der PHP chinesischen Website!

Heiße KI -Werkzeuge

Undresser.AI Undress
KI-gestützte App zum Erstellen realistischer Aktfotos

AI Clothes Remover
Online-KI-Tool zum Entfernen von Kleidung aus Fotos.

Undress AI Tool
Ausziehbilder kostenlos

Clothoff.io
KI-Kleiderentferner

AI Hentai Generator
Erstellen Sie kostenlos Ai Hentai.

Heißer Artikel

Heiße Werkzeuge

Notepad++7.3.1
Einfach zu bedienender und kostenloser Code-Editor

SublimeText3 chinesische Version
Chinesische Version, sehr einfach zu bedienen

Senden Sie Studio 13.0.1
Leistungsstarke integrierte PHP-Entwicklungsumgebung

Dreamweaver CS6
Visuelle Webentwicklungstools

SublimeText3 Mac-Version
Codebearbeitungssoftware auf Gottesniveau (SublimeText3)

Heiße Themen
 1376
1376
 52
52
 Laravels Geospatial: Optimierung interaktiver Karten und großen Datenmengen
Apr 08, 2025 pm 12:24 PM
Laravels Geospatial: Optimierung interaktiver Karten und großen Datenmengen
Apr 08, 2025 pm 12:24 PM
Verarbeiten Sie 7 Millionen Aufzeichnungen effizient und erstellen Sie interaktive Karten mit Geospatial -Technologie. In diesem Artikel wird untersucht, wie über 7 Millionen Datensätze mithilfe von Laravel und MySQL effizient verarbeitet und in interaktive Kartenvisualisierungen umgewandelt werden können. Erstes Herausforderungsprojektanforderungen: Mit 7 Millionen Datensätzen in der MySQL -Datenbank wertvolle Erkenntnisse extrahieren. Viele Menschen erwägen zunächst Programmiersprachen, aber ignorieren die Datenbank selbst: Kann sie den Anforderungen erfüllen? Ist Datenmigration oder strukturelle Anpassung erforderlich? Kann MySQL einer so großen Datenbelastung standhalten? Voranalyse: Schlüsselfilter und Eigenschaften müssen identifiziert werden. Nach der Analyse wurde festgestellt, dass nur wenige Attribute mit der Lösung zusammenhängen. Wir haben die Machbarkeit des Filters überprüft und einige Einschränkungen festgelegt, um die Suche zu optimieren. Kartensuche basierend auf der Stadt
 Wie man MySQL löst, kann nicht gestartet werden
Apr 08, 2025 pm 02:21 PM
Wie man MySQL löst, kann nicht gestartet werden
Apr 08, 2025 pm 02:21 PM
Es gibt viele Gründe, warum MySQL Startup fehlschlägt und durch Überprüfung des Fehlerprotokolls diagnostiziert werden kann. Zu den allgemeinen Ursachen gehören Portkonflikte (prüfen Portbelegung und Änderung der Konfiguration), Berechtigungsprobleme (Überprüfen Sie den Dienst Ausführen von Benutzerberechtigungen), Konfigurationsdateifehler (Überprüfung der Parametereinstellungen), Datenverzeichniskorruption (Wiederherstellung von Daten oder Wiederaufbautabellenraum), InnoDB-Tabellenraumprobleme (prüfen IBDATA1-Dateien), Plug-in-Ladeversagen (Überprüfen Sie Fehlerprotokolle). Wenn Sie Probleme lösen, sollten Sie sie anhand des Fehlerprotokolls analysieren, die Hauptursache des Problems finden und die Gewohnheit entwickeln, Daten regelmäßig zu unterstützen, um Probleme zu verhindern und zu lösen.
 So verwenden Sie MySQL nach der Installation
Apr 08, 2025 am 11:48 AM
So verwenden Sie MySQL nach der Installation
Apr 08, 2025 am 11:48 AM
Der Artikel führt den Betrieb der MySQL -Datenbank vor. Zunächst müssen Sie einen MySQL -Client wie MySQLworkBench oder Befehlszeilen -Client installieren. 1. Verwenden Sie den Befehl mySQL-uroot-P, um eine Verbindung zum Server herzustellen und sich mit dem Stammkonto-Passwort anzumelden. 2. Verwenden Sie die Erstellung von Createdatabase, um eine Datenbank zu erstellen, und verwenden Sie eine Datenbank aus. 3.. Verwenden Sie CreateTable, um eine Tabelle zu erstellen, Felder und Datentypen zu definieren. 4. Verwenden Sie InsertInto, um Daten einzulegen, Daten abzufragen, Daten nach Aktualisierung zu aktualisieren und Daten nach Löschen zu löschen. Nur indem Sie diese Schritte beherrschen, lernen, mit gemeinsamen Problemen umzugehen und die Datenbankleistung zu optimieren, können Sie MySQL effizient verwenden.
 Remote Senior Backend Engineers (Plattformen) benötigen Kreise
Apr 08, 2025 pm 12:27 PM
Remote Senior Backend Engineers (Plattformen) benötigen Kreise
Apr 08, 2025 pm 12:27 PM
Remote Senior Backend Engineer Job Vacant Company: Circle Standort: Remote-Büro-Jobtyp: Vollzeitgehalt: 130.000 bis 140.000 US-Dollar Stellenbeschreibung Nehmen Sie an der Forschung und Entwicklung von Mobilfunkanwendungen und öffentlichen API-bezogenen Funktionen, die den gesamten Lebenszyklus der Softwareentwicklung abdecken. Die Hauptaufgaben erledigen die Entwicklungsarbeit unabhängig von RubyonRails und arbeiten mit dem Front-End-Team von React/Redux/Relay zusammen. Erstellen Sie die Kernfunktionalität und -verbesserungen für Webanwendungen und arbeiten Sie eng mit Designer und Führung während des gesamten funktionalen Designprozesses zusammen. Fördern Sie positive Entwicklungsprozesse und priorisieren Sie die Iterationsgeschwindigkeit. Erfordert mehr als 6 Jahre komplexes Backend für Webanwendungen
 Kann MySQL JSON zurückgeben?
Apr 08, 2025 pm 03:09 PM
Kann MySQL JSON zurückgeben?
Apr 08, 2025 pm 03:09 PM
MySQL kann JSON -Daten zurückgeben. Die JSON_EXTRACT -Funktion extrahiert Feldwerte. Über komplexe Abfragen sollten Sie die Where -Klausel verwenden, um JSON -Daten zu filtern, aber auf die Leistungsauswirkungen achten. Die Unterstützung von MySQL für JSON nimmt ständig zu, und es wird empfohlen, auf die neuesten Versionen und Funktionen zu achten.
 Verstehen von Säureeigenschaften: Die Säulen einer zuverlässigen Datenbank
Apr 08, 2025 pm 06:33 PM
Verstehen von Säureeigenschaften: Die Säulen einer zuverlässigen Datenbank
Apr 08, 2025 pm 06:33 PM
Detaillierte Erläuterung von Datenbanksäureattributen Säureattribute sind eine Reihe von Regeln, um die Zuverlässigkeit und Konsistenz von Datenbanktransaktionen sicherzustellen. Sie definieren, wie Datenbanksysteme Transaktionen umgehen, und sorgen dafür, dass die Datenintegrität und -genauigkeit auch im Falle von Systemabstürzen, Leistungsunterbrechungen oder mehreren Benutzern gleichzeitiger Zugriff. Säureattributübersicht Atomizität: Eine Transaktion wird als unteilbare Einheit angesehen. Jeder Teil schlägt fehl, die gesamte Transaktion wird zurückgerollt und die Datenbank behält keine Änderungen bei. Wenn beispielsweise eine Banküberweisung von einem Konto abgezogen wird, jedoch nicht auf ein anderes erhöht wird, wird der gesamte Betrieb widerrufen. begintransaktion; updateAccountsSetBalance = Balance-100WH
 MySQL kann nach dem Herunterladen nicht installiert werden
Apr 08, 2025 am 11:24 AM
MySQL kann nach dem Herunterladen nicht installiert werden
Apr 08, 2025 am 11:24 AM
Die Hauptgründe für den Fehler bei MySQL -Installationsfehlern sind: 1. Erlaubnisprobleme, Sie müssen als Administrator ausgeführt oder den Sudo -Befehl verwenden. 2. Die Abhängigkeiten fehlen, und Sie müssen relevante Entwicklungspakete installieren. 3. Portkonflikte müssen Sie das Programm schließen, das Port 3306 einnimmt, oder die Konfigurationsdatei ändern. 4. Das Installationspaket ist beschädigt. Sie müssen die Integrität herunterladen und überprüfen. 5. Die Umgebungsvariable ist falsch konfiguriert und die Umgebungsvariablen müssen korrekt entsprechend dem Betriebssystem konfiguriert werden. Lösen Sie diese Probleme und überprüfen Sie jeden Schritt sorgfältig, um MySQL erfolgreich zu installieren.
 Der Hauptschlüssel von MySQL kann null sein
Apr 08, 2025 pm 03:03 PM
Der Hauptschlüssel von MySQL kann null sein
Apr 08, 2025 pm 03:03 PM
Der MySQL -Primärschlüssel kann nicht leer sein, da der Primärschlüssel ein Schlüsselattribut ist, das jede Zeile in der Datenbank eindeutig identifiziert. Wenn der Primärschlüssel leer sein kann, kann der Datensatz nicht eindeutig identifiziert werden, was zu Datenverwirrung führt. Wenn Sie selbstsinkrementelle Ganzzahlsspalten oder UUIDs als Primärschlüssel verwenden, sollten Sie Faktoren wie Effizienz und Raumbelegung berücksichtigen und eine geeignete Lösung auswählen.



