 Technologie-Peripheriegeräte
Technologie-Peripheriegeräte
 KI
KI
 Vorhersage optimaler Optionen für die Synthese von Arzneimittelmolekülen mithilfe geometrischer Deep-Learning-Methoden und ebnet so den Weg für die Entdeckung neuer Arzneimittel
Vorhersage optimaler Optionen für die Synthese von Arzneimittelmolekülen mithilfe geometrischer Deep-Learning-Methoden und ebnet so den Weg für die Entdeckung neuer Arzneimittel
Vorhersage optimaler Optionen für die Synthese von Arzneimittelmolekülen mithilfe geometrischer Deep-Learning-Methoden und ebnet so den Weg für die Entdeckung neuer Arzneimittel

Postfunktionalisierung ist eine wirtschaftliche Methode zur Optimierung der Eigenschaften von Arzneimittelkandidaten. Allerdings macht die chemische Komplexität von Arzneimittelmolekülen die Funktionalisierung im Spätstadium oft zu einer Herausforderung.
Um dieses Problem zu lösen, haben Forscher der Universität München, der ETH Zürich und Roche Basel gemeinsam eine Plattform für die Funktionalisierung im Spätstadium entwickelt Deep Learning und Hochdurchsatz-Reaktionsscreening-Technologie
Angesichts der Tatsache, dass die Borylierung einer der Schlüsselschritte der Funktionalisierung ist, haben wir Computermodelle verwendet, um die Ausbeute unter verschiedenen Reaktionsbedingungen mit einem durchschnittlichen absoluten Fehlerbereich von 4–5 % vorherzusagen. Das Modell war in der Lage, neue Reaktionen für bekannte und unbekannte Substrate mit einer Genauigkeit von 92 % bzw. 67 % zu klassifizieren. Mit einem F-Score von 67 % für den Klassifikator konnten wir die Regioselektivität des Hauptprodukts genau erfassen. Bei der Anwendung auf 23 verschiedene kommerzielle Arzneimittelmoleküle haben wir erfolgreich viele Möglichkeiten zur strukturellen Diversifizierung entdeckt. Die Studie trägt den Titel „Using Geometric Deep Learning to Enable High-Throughput Experiments to Promote Late-stage Drug Diversification“ und wurde im November 2023 veröffentlicht in der Fachzeitschrift Nature Chemistry vom 23. März

Neuheit von Strukturen bei der Herstellung von Struktur-Aktivitäts-Beziehungen in der medizinischen Chemie und Komplexität machen die Synthese chemischer Zielstrukturen zu einer Herausforderung. Struktur-Aktivitäts-Beziehungsmodelle können Leitsubstanzen und Optimierungspläne für Leitsubstanzen leiten, um die pharmakologische Aktivität und die physikalisch-chemischen Eigenschaften von Arzneimittelkandidaten zu verbessern. Für die Erforschung von Struktur-Aktivitäts-Beziehungen ist eine effiziente Integration von entscheidender Bedeutung, die den Flaschenhals im Design-Herstellung-Test-Analyse-Zyklus darstellt
Es gibt viele alternative Methoden zur Aktivierung und Modifizierung von C-H-Bindungen für die Funktionalisierung organischer Gerüste im Spätstadium ( LSF), von molekularen Bausteinen bis hin zu fortschrittlichen pharmazeutischen Molekülen. Viele katalytische Systeme bieten gerichtete und ungerichtete Ansätze sowie einen chemischen und ortsselektiven Zugang zu modifizierten Analoga
Unter den zahlreichen LSF-Methoden gilt die C-H-Borylierungsmethode als die am häufigsten verwendete Methode zur schnellen Diversifizierung von Verbindungen. Organoborverbindungen können als zuverlässiges Mittel für nachfolgende C-C-Bindungskupplungsreaktionen in eine Vielzahl funktioneller Gruppen umgewandelt werden und ermöglichen so eine umfassende Erforschung der Struktur-Aktivitäts-Beziehungen.
Allerdings gibt es derzeit nur wenige Anwendungen von LSF in der Arzneimittelforschung. Die meisten dieser Berichte konzentrieren sich auf einen einzelnen LSF-Reaktionstyp. Die direkte LSF mehrerer Arten von C-H-Bindungen mit unterschiedlichen Bindungsstärken, elektronischen Eigenschaften sowie sterischen und funktionellen Gruppenumgebungen stellt Herausforderungen dar. Darüber hinaus ist die Durchführung von LSF-Projekten oft zeit- und ressourcenintensiv, was nicht mit den engen Zeitplänen und begrenzten Ressourcen vieler medizinischer Chemieprojekte vereinbar ist. Die Grafik zeigt einen Überblick über die Forschung zur Diversifizierung der Borisierung. (Datenquelle: Papier)
Künstliche Intelligenz unterstütztes LSF (Language Support Feature)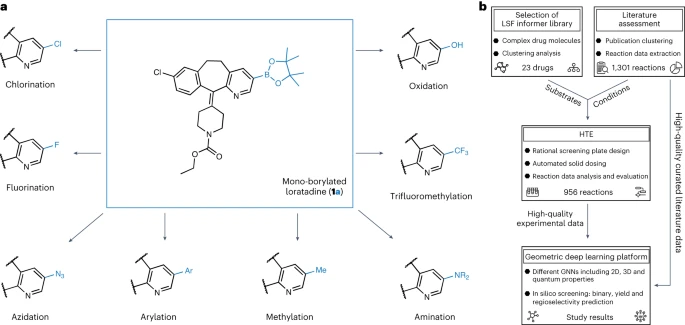
Allerdings sind diese Methoden auf kleine Molekülstrukturen und relativ kleine Datensätze beschränkt, was es schwierig macht Wenden Sie solche Modelle auf strukturell komplexere wirkstoffähnliche Moleküle an. Basierend auf Literaturrecherchen kann die Regioselektivität Iridium-katalysierter Borylierungsreaktionen durch ein hybrides maschinelles Lernmodell vorhergesagt werden, das mit quantenchemischen Informationen über Übergangszustände erweitert wird. Der Einfluss sterischer und elektronischer Effekte auf die Leistung von C-H-Aktivierungsreaktionsmodellen und ihre regioselektiven Anwendungen in Molekülen mit mehreren aromatischen Ringsystemen wurde jedoch noch nicht untersucht Automatisiertes LSF-Borisierungs-Screening mit geometrischem Deep Learning Forscher der Universität München, der ETH Zürich und Roche Pharmaceuticals Basel stellen eine automatisierte LSF-Borisierungs-Screening-Methode vor, die auf geometrisches Deep Learning angewendet wird, um Möglichkeiten zur Hit- und Lead-Diversifizierung im Spätstadium zu identifizieren. Computational Deep Learning wurde eingesetzt, um das Reaktionsergebnis, die Ausbeute und die Regioselektivität komplexer LSF-Wirkstoffmoleküle vorherzusagen. David Nippa, Hauptautor und Doktorand in der Forschungsgruppe an der Fakultät für Chemie und Pharmazie der LMU und Roche, sagte, dass mit diesem Ansatz die Anzahl der Laborexperimente deutlich reduziert und dadurch die Effizienz gesteigert werden könne chemische Synthese. und Nachhaltigkeit Für die ersten Schritte dieser Forschung führten wir eine gründliche Analyse der veröffentlichten Literatur durch, um geeignete Hochdurchsatz-Screening-Reaktionsbedingungen und Substrate auszuwählen, die für die Eigenschaften von Leitverbindungen im Spätstadium der Arzneimittelforschung relevant sind. Wir haben die Reaktionsbedingungen anhand eines manuell organisierten Literaturdatensatzes von 38 Artikeln ermittelt. Die Auswahl des LSF-Substrats basierte auf den Ergebnissen der Clusteranalyse von 1.174 zugelassenen Arzneimitteln, was zu 23 strukturell unterschiedlichen Arzneimittelmolekülen führte. Dieser Ansatz ermöglicht es Forschern, relevante Beispiele für Reaktionsbedingungen und Substrate in einem „Informationsbibliotheks“-Ansatz zu verwenden, anstatt sich ausschließlich auf ideale Substrate und Fragmente mit begrenzter Anwendbarkeit zu verlassen, um die Leitverbindungssynthese zu optimieren. Im zweiten Schritt verwenden Forscher semi -Automatisierte Hochdurchsatzexperimente (HTE) zur Generierung von Daten (experimentelle Datensätze). Die Reaktionsdaten der ausgewählten Arzneimittelmoleküle und Reaktionsbedingungen liefern hochwertige Daten für das maschinelle Lernen nachfolgender Reaktionsergebnisse. Schließlich trainierten wir verschiedene Graph-Neural-Network-Modelle (GNN) unter Verwendung zweidimensionaler, dreidimensionaler und atomarer Teilladungen Verstärkung Verwenden Sie molekulare Graphen, um binäre Reaktionsergebnisse, Reaktionsausbeuten und Regioselektivitäten vorherzusagen. „Interessanterweise verbesserten sich die Vorhersagen, wenn wir dreidimensionale Informationen über das Ausgangsmaterial und nicht nur seine zweidimensionale chemische Formel berücksichtigten“, sagte Kenneth Atz, Doktorand an der ETH Zürich. Dieser Ansatz wurde erfolgreich zur Identifizierung von Positionen eingesetzt innerhalb bestehender Wirkstoffe, wo zusätzliche reaktive Gruppen eingeführt werden können. Dies wird Forschern helfen, schneller neue, wirksamere Varianten bekannter pharmazeutischer Wirkstoffe zu entwickeln 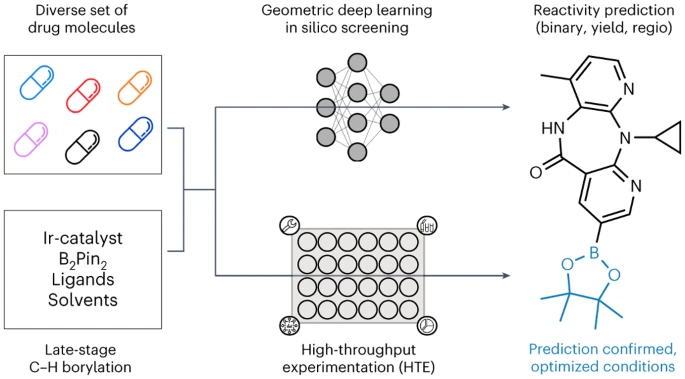
Das obige ist der detaillierte Inhalt vonVorhersage optimaler Optionen für die Synthese von Arzneimittelmolekülen mithilfe geometrischer Deep-Learning-Methoden und ebnet so den Weg für die Entdeckung neuer Arzneimittel. Für weitere Informationen folgen Sie bitte anderen verwandten Artikeln auf der PHP chinesischen Website!

Heiße KI -Werkzeuge

Undresser.AI Undress
KI-gestützte App zum Erstellen realistischer Aktfotos

AI Clothes Remover
Online-KI-Tool zum Entfernen von Kleidung aus Fotos.

Undress AI Tool
Ausziehbilder kostenlos

Clothoff.io
KI-Kleiderentferner

AI Hentai Generator
Erstellen Sie kostenlos Ai Hentai.

Heißer Artikel

Heiße Werkzeuge

Notepad++7.3.1
Einfach zu bedienender und kostenloser Code-Editor

SublimeText3 chinesische Version
Chinesische Version, sehr einfach zu bedienen

Senden Sie Studio 13.0.1
Leistungsstarke integrierte PHP-Entwicklungsumgebung

Dreamweaver CS6
Visuelle Webentwicklungstools

SublimeText3 Mac-Version
Codebearbeitungssoftware auf Gottesniveau (SublimeText3)

Heiße Themen
 1378
1378
 52
52
 Der DeepMind-Roboter spielt Tischtennis und seine Vor- und Rückhand rutschen in die Luft, wodurch menschliche Anfänger völlig besiegt werden
Aug 09, 2024 pm 04:01 PM
Der DeepMind-Roboter spielt Tischtennis und seine Vor- und Rückhand rutschen in die Luft, wodurch menschliche Anfänger völlig besiegt werden
Aug 09, 2024 pm 04:01 PM
Aber vielleicht kann er den alten Mann im Park nicht besiegen? Die Olympischen Spiele in Paris sind in vollem Gange und Tischtennis hat viel Aufmerksamkeit erregt. Gleichzeitig haben Roboter auch beim Tischtennisspielen neue Durchbrüche erzielt. Gerade hat DeepMind den ersten lernenden Roboteragenten vorgeschlagen, der das Niveau menschlicher Amateurspieler im Tischtennis-Wettkampf erreichen kann. Papieradresse: https://arxiv.org/pdf/2408.03906 Wie gut ist der DeepMind-Roboter beim Tischtennisspielen? Vermutlich auf Augenhöhe mit menschlichen Amateurspielern: Sowohl Vorhand als auch Rückhand: Der Gegner nutzt unterschiedliche Spielstile, und auch der Roboter hält aus: Aufschlagannahme mit unterschiedlichem Spin: Allerdings scheint die Intensität des Spiels nicht so intensiv zu sein wie Der alte Mann im Park. Für Roboter, Tischtennis
 Die erste mechanische Klaue! Yuanluobao trat auf der Weltroboterkonferenz 2024 auf und stellte den ersten Schachroboter vor, der das Haus betreten kann
Aug 21, 2024 pm 07:33 PM
Die erste mechanische Klaue! Yuanluobao trat auf der Weltroboterkonferenz 2024 auf und stellte den ersten Schachroboter vor, der das Haus betreten kann
Aug 21, 2024 pm 07:33 PM
Am 21. August fand in Peking die Weltroboterkonferenz 2024 im großen Stil statt. Die Heimrobotermarke „Yuanluobot SenseRobot“ von SenseTime hat ihre gesamte Produktfamilie vorgestellt und kürzlich den Yuanluobot AI-Schachspielroboter – Chess Professional Edition (im Folgenden als „Yuanluobot SenseRobot“ bezeichnet) herausgebracht und ist damit der weltweit erste A-Schachroboter für heim. Als drittes schachspielendes Roboterprodukt von Yuanluobo hat der neue Guoxiang-Roboter eine Vielzahl spezieller technischer Verbesserungen und Innovationen in den Bereichen KI und Maschinenbau erfahren und erstmals die Fähigkeit erkannt, dreidimensionale Schachfiguren aufzunehmen B. durch mechanische Klauen an einem Heimroboter, und führen Sie Mensch-Maschine-Funktionen aus, z. B. Schach spielen, jeder spielt Schach, Überprüfung der Notation usw.
 Claude ist auch faul geworden! Netizen: Lernen Sie, sich einen Urlaub zu gönnen
Sep 02, 2024 pm 01:56 PM
Claude ist auch faul geworden! Netizen: Lernen Sie, sich einen Urlaub zu gönnen
Sep 02, 2024 pm 01:56 PM
Der Schulstart steht vor der Tür und nicht nur die Schüler, die bald ins neue Semester starten, sollten auf sich selbst aufpassen, sondern auch die großen KI-Modelle. Vor einiger Zeit war Reddit voller Internetnutzer, die sich darüber beschwerten, dass Claude faul werde. „Sein Niveau ist stark gesunken, es kommt oft zu Pausen und sogar die Ausgabe wird sehr kurz. In der ersten Woche der Veröffentlichung konnte es ein komplettes 4-seitiges Dokument auf einmal übersetzen, aber jetzt kann es nicht einmal eine halbe Seite ausgeben.“ !
 Auf der Weltroboterkonferenz wurde dieser Haushaltsroboter, der „die Hoffnung auf eine zukünftige Altenpflege' in sich trägt, umzingelt
Aug 22, 2024 pm 10:35 PM
Auf der Weltroboterkonferenz wurde dieser Haushaltsroboter, der „die Hoffnung auf eine zukünftige Altenpflege' in sich trägt, umzingelt
Aug 22, 2024 pm 10:35 PM
Auf der World Robot Conference in Peking ist die Präsentation humanoider Roboter zum absoluten Mittelpunkt der Szene geworden. Am Stand von Stardust Intelligent führte der KI-Roboterassistent S1 drei große Darbietungen mit Hackbrett, Kampfkunst und Kalligraphie auf Ein Ausstellungsbereich, der sowohl Literatur als auch Kampfkunst umfasst, zog eine große Anzahl von Fachpublikum und Medien an. Durch das elegante Spiel auf den elastischen Saiten demonstriert der S1 eine feine Bedienung und absolute Kontrolle mit Geschwindigkeit, Kraft und Präzision. CCTV News führte einen Sonderbericht über das Nachahmungslernen und die intelligente Steuerung hinter „Kalligraphie“ durch. Firmengründer Lai Jie erklärte, dass hinter den seidenweichen Bewegungen die Hardware-Seite die beste Kraftkontrolle und die menschenähnlichsten Körperindikatoren (Geschwindigkeit, Belastung) anstrebt. usw.), aber auf der KI-Seite werden die realen Bewegungsdaten von Menschen gesammelt, sodass der Roboter stärker werden kann, wenn er auf eine schwierige Situation stößt, und lernen kann, sich schnell weiterzuentwickeln. Und agil
 Bekanntgabe der ACL 2024 Awards: Eines der besten Papers zum Thema Oracle Deciphering von HuaTech, GloVe Time Test Award
Aug 15, 2024 pm 04:37 PM
Bekanntgabe der ACL 2024 Awards: Eines der besten Papers zum Thema Oracle Deciphering von HuaTech, GloVe Time Test Award
Aug 15, 2024 pm 04:37 PM
Bei dieser ACL-Konferenz haben die Teilnehmer viel gewonnen. Die sechstägige ACL2024 findet in Bangkok, Thailand, statt. ACL ist die führende internationale Konferenz im Bereich Computerlinguistik und Verarbeitung natürlicher Sprache. Sie wird von der International Association for Computational Linguistics organisiert und findet jährlich statt. ACL steht seit jeher an erster Stelle, wenn es um akademischen Einfluss im Bereich NLP geht, und ist außerdem eine von der CCF-A empfohlene Konferenz. Die diesjährige ACL-Konferenz ist die 62. und hat mehr als 400 innovative Arbeiten im Bereich NLP eingereicht. Gestern Nachmittag gab die Konferenz den besten Vortrag und weitere Auszeichnungen bekannt. Diesmal gibt es 7 Best Paper Awards (zwei davon unveröffentlicht), 1 Best Theme Paper Award und 35 Outstanding Paper Awards. Die Konferenz verlieh außerdem drei Resource Paper Awards (ResourceAward) und einen Social Impact Award (
 Hongmeng Smart Travel S9 und die umfassende Einführungskonferenz für neue Produkte wurden gemeinsam mit einer Reihe neuer Blockbuster-Produkte veröffentlicht
Aug 08, 2024 am 07:02 AM
Hongmeng Smart Travel S9 und die umfassende Einführungskonferenz für neue Produkte wurden gemeinsam mit einer Reihe neuer Blockbuster-Produkte veröffentlicht
Aug 08, 2024 am 07:02 AM
Heute Nachmittag begrüßte Hongmeng Zhixing offiziell neue Marken und neue Autos. Am 6. August veranstaltete Huawei die Hongmeng Smart Xingxing S9 und die Huawei-Konferenz zur Einführung neuer Produkte mit umfassendem Szenario und brachte die Panorama-Smart-Flaggschiff-Limousine Xiangjie S9, das neue M7Pro und Huawei novaFlip, MatePad Pro 12,2 Zoll, das neue MatePad Air und Huawei Bisheng mit Mit vielen neuen Smart-Produkten für alle Szenarien, darunter die Laserdrucker der X1-Serie, FreeBuds6i, WATCHFIT3 und der Smart Screen S5Pro, von Smart Travel über Smart Office bis hin zu Smart Wear baut Huawei weiterhin ein Smart-Ökosystem für alle Szenarien auf, um Verbrauchern ein Smart-Erlebnis zu bieten Internet von allem. Hongmeng Zhixing: Huawei arbeitet mit chinesischen Partnern aus der Automobilindustrie zusammen, um die Modernisierung der Smart-Car-Industrie voranzutreiben
 Das Team von Li Feifei schlug ReKep vor, um Robotern räumliche Intelligenz zu verleihen und GPT-4o zu integrieren
Sep 03, 2024 pm 05:18 PM
Das Team von Li Feifei schlug ReKep vor, um Robotern räumliche Intelligenz zu verleihen und GPT-4o zu integrieren
Sep 03, 2024 pm 05:18 PM
Tiefe Integration von Vision und Roboterlernen. Wenn zwei Roboterhände reibungslos zusammenarbeiten, um Kleidung zu falten, Tee einzuschenken und Schuhe zu packen, gepaart mit dem humanoiden 1X-Roboter NEO, der in letzter Zeit für Schlagzeilen gesorgt hat, haben Sie vielleicht das Gefühl: Wir scheinen in das Zeitalter der Roboter einzutreten. Tatsächlich sind diese seidigen Bewegungen das Produkt fortschrittlicher Robotertechnologie + exquisitem Rahmendesign + multimodaler großer Modelle. Wir wissen, dass nützliche Roboter oft komplexe und exquisite Interaktionen mit der Umgebung erfordern und die Umgebung als Einschränkungen im räumlichen und zeitlichen Bereich dargestellt werden kann. Wenn Sie beispielsweise möchten, dass ein Roboter Tee einschenkt, muss der Roboter zunächst den Griff der Teekanne ergreifen und sie aufrecht halten, ohne den Tee zu verschütten, und ihn dann sanft bewegen, bis die Öffnung der Kanne mit der Öffnung der Tasse übereinstimmt , und neigen Sie dann die Teekanne in einem bestimmten Winkel. Das
 Distributed Artificial Intelligence Conference DAI 2024 Call for Papers: Agent Day, Richard Sutton, der Vater des Reinforcement Learning, wird teilnehmen! Yan Shuicheng, Sergey Levine und DeepMind-Wissenschaftler werden Grundsatzreden halten
Aug 22, 2024 pm 08:02 PM
Distributed Artificial Intelligence Conference DAI 2024 Call for Papers: Agent Day, Richard Sutton, der Vater des Reinforcement Learning, wird teilnehmen! Yan Shuicheng, Sergey Levine und DeepMind-Wissenschaftler werden Grundsatzreden halten
Aug 22, 2024 pm 08:02 PM
Einleitung zur Konferenz Mit der rasanten Entwicklung von Wissenschaft und Technologie ist künstliche Intelligenz zu einer wichtigen Kraft bei der Förderung des sozialen Fortschritts geworden. In dieser Zeit haben wir das Glück, die Innovation und Anwendung der verteilten künstlichen Intelligenz (DAI) mitzuerleben und daran teilzuhaben. Verteilte Künstliche Intelligenz ist ein wichtiger Zweig des Gebiets der Künstlichen Intelligenz, der in den letzten Jahren immer mehr Aufmerksamkeit erregt hat. Durch die Kombination des leistungsstarken Sprachverständnisses und der Generierungsfähigkeiten großer Modelle sind plötzlich Agenten aufgetaucht, die auf natürlichen Sprachinteraktionen, Wissensbegründung, Aufgabenplanung usw. basieren. AIAgent übernimmt das große Sprachmodell und ist zu einem heißen Thema im aktuellen KI-Kreis geworden. Au



