 Périphériques technologiques
Périphériques technologiques
 IA
IA
 Atteignant une grande polyvalence avec de petites quantités de données, KAIST développe un nouveau cadre pour la génération de molécules 3D pour la conception de médicaments
Atteignant une grande polyvalence avec de petites quantités de données, KAIST développe un nouveau cadre pour la génération de molécules 3D pour la conception de médicaments
Atteignant une grande polyvalence avec de petites quantités de données, KAIST développe un nouveau cadre pour la génération de molécules 3D pour la conception de médicaments
Éditeur | Radis Skin
Les modèles génératifs profonds ont un grand potentiel pour accélérer la conception de médicaments. Cependant, les modèles génératifs existants sont souvent confrontés à des problèmes de généralisation en raison du nombre limité de données, ce qui donne lieu à des conceptions moins innovantes.
Pour résoudre ces problèmes, des chercheurs du KAIST en Corée du Sud ont proposé un cadre fonctionnel de génération moléculaire 3D sensible aux interactions qui permet une conception d'interaction guidée par l'interaction au sein de la poche de liaison cible. En utilisant des modèles communs d’interactions protéine-ligand comme connaissances préalables, le modèle peut atteindre un degré élevé de généralité avec des données expérimentales limitées. Dans le même temps, en utilisant la masse protéique-ligand comme modèle général à des fins d’interaction, le modèle peut atteindre un bon équilibre entre généralité et spécificité élevée, ce qui fournit une généralité et une prévisibilité pour la conception de médicaments.
Les performances des ligands cibles invisibles générés ont été évaluées de manière exhaustive en analysant la certitude, l'affinité, la diversité et la nouveauté de leur pose de liaison. En outre, la conception efficace d’inhibiteurs potentiels sélectifs des mutations démontre l’applicabilité de cette approche à la conception de médicaments basée sur la structure.
L'étude s'intitulait « Cadre génératif moléculaire 3D pour la conception de médicaments guidés par interaction » et a été publiée dans « Nature Communications » le 27 mars 2024.

Dans la capture de données et les problèmes scientifiques, une connaissance préalable hiérarchique appropriée des modèles d'apprentissage profond est cruciale pour développer des modèles généralisables. Par exemple, AlphaFold prédit avec succès les structures des protéines en exploitant les informations coévolutives et les représentations de paires de résidus. Les modèles génératifs profonds modifient le paradigme de conception de médicaments, mais leurs performances sont limitées par le manque de données sur l'activité des molécules médicamenteuses, ce qui entraîne de faibles capacités de généralisation. Pour améliorer les performances des modèles génératifs profonds, nous avons besoin de connaissances préalables appropriées pour garantir leur adéquation à la généralisation des données sur l’activité des molécules médicamenteuses, ce qui est essentiel pour prédire les structures et propriétés complexes des composés.
Les modèles fonctionnels génératifs récents améliorent les capacités de formation d'onde du modèle en utilisant la structure tridimensionnelle du site de liaison pour la conception de ligands basée sur la structure sans s'appuyer sur les données d'activité. Un modèle bien ondulé doit comprendre les propriétés universelles des interactions protéine-ligand, notamment les liaisons hydrogène, les ponts salins, les interactions hydrophobes et l'empilement π-π. Ceci est essentiel pour former une structure de liaison stable et maintenir une affinité élevée. Ces modèles d’interaction omniprésents constituent la base de la conception de médicaments puissants.
Sur la base de ces circonstances, les chercheurs du KAIST ont proposé un cadre de génération moléculaire 3D sensible aux interactions. Ce cadre exploite la nature universelle des interactions protéine-ligand pour guider la conception de médicaments basés sur la structure. Le cadre se compose de deux étapes principales : (1) la définition des conditions de détection d’interaction et (2) la génération de molécules 3D en interaction.
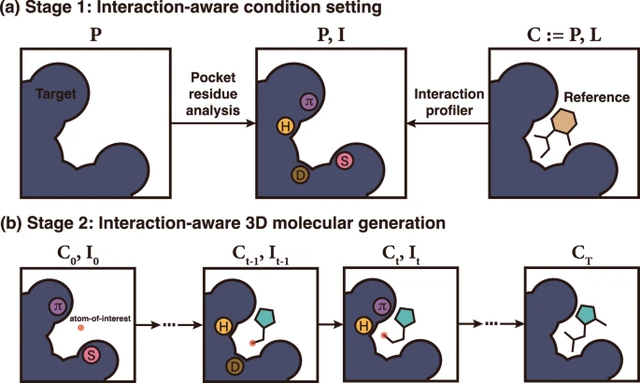
Illustration : Illustration du concept de cadre. (Source : article)
La première étape du cadre vise à définir les conditions d'interaction I en étudiant les atomes de protéines pour un site de liaison P donné. Les chercheurs ont utilisé quatre types d’interactions protéine-ligand : liaisons hydrogène, ponts salins, interactions hydrophobes et empilement π-π. Ici, les chercheurs n’ont considéré que les quatre types d’interactions les plus dominants dans la banque de données sur les protéines (PDB), principalement parce qu’ils ont utilisé l’ensemble de données PDBbind 2020 dérivé de la PDB pour la formation du modèle.
Parallèlement, l'équipe a développé une stratégie de régulation par détection des interactions atomiques protéiques. Les chercheurs définissent les conditions d'interaction comme un vecteur unique de types d'interaction supplémentaires pour un ensemble d'atomes de protéines, qui indique si un atome peut participer à une interaction spécifique et son rôle dans l'interaction.
Les atomes de protéines sont divisés en sept catégories : anions, cations, donneurs et accepteurs de liaisons hydrogène, atomes aromatiques, hydrophobes et sans interaction. Au lieu de représenter l’intégralité des informations d’interaction sous la forme d’une seule empreinte digitale d’interaction, la stratégie de l’équipe vise à établir les conditions d’interaction localement.
Dans ce travail, les chercheurs ont principalement déterminé les catégories d'interaction des atomes du sac à travers deux stratégies.
Pendant la phase de génération, les informations sur les interactions récepteur-ligand n'étant pas toujours disponibles, des critères de catégories d'interaction sont prédéfinis afin de spécifier les conditions d'interaction en analysant chaque atome de protéine. Ce paramètre de condition est appelé condition d'interaction sans référence.
Pendant la phase d'entraînement, les structures de vérité terrain des complexes protéine-ligand sont utilisées pour extraire les conditions d'interaction.
Les chercheurs ont également proposé un modèle génératif profond appelé DeepICL pour l'ingénierie inverse des ligands, qui génère progressivement des atomes dans le ligand en fonction de l'environnement tridimensionnel de la poche et des conditions d'interaction de la première étape.
Bien que la poche cible puisse former différentes combinaisons de types d'interaction protéine-ligand en fonction du ligand lié et de sa position de liaison ; l'objectif de l'équipe est d'utiliser un modèle génératif conditionnel 3D appelé DeepICL pour procéder à l'ingénierie inverse qui satisfait des interactions spécifiques combinant des ligands, le modèle peut être appliqué à tout type de protéine. Les chercheurs utilisent des conditions d’interaction locales dans les sous-poches auxquelles les ligands doivent se lier, plutôt que d’utiliser l’intégralité des informations d’interaction, pour éviter les biais indésirables en faveur de poches ou de structures de ligands spécifiques.
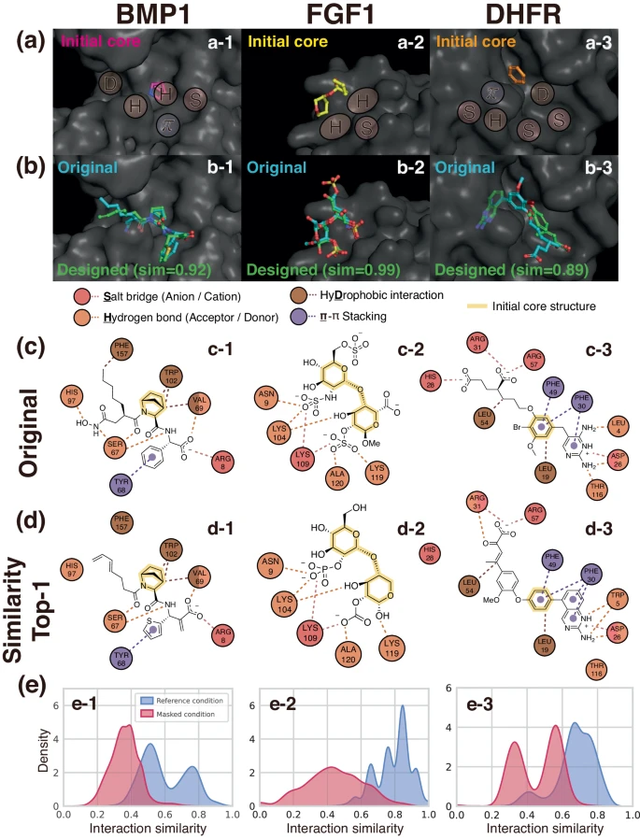
Illustration : Exemple d'élaboration d'un ligand conditionnel sensible aux interactions. (Source : article)
Pour démontrer la capacité du cadre à réaliser une conception générale de médicaments basée sur la structure, plutôt que d'utiliser des références typiques composées de 105 à 107 structures de liaison protéine-ligand générées par ordinateur, les chercheurs ont uniquement utilisé les données de la base de données PDBbind. 104 structures cristallines réelles ont été sélectionnées car un bon modèle de généralisation peut extraire avec succès les caractéristiques appropriées, même pour des données à petite échelle.
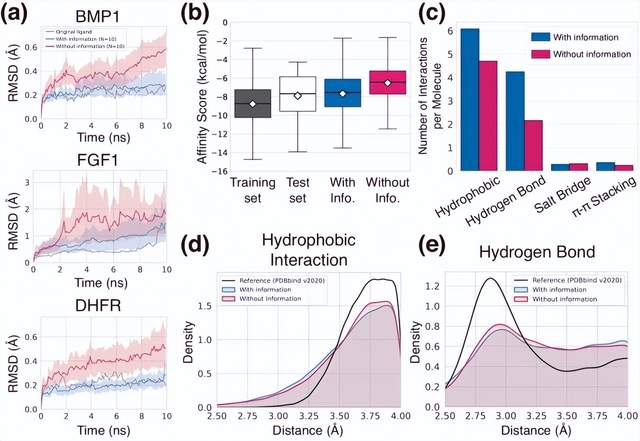
Illustration : L'universalité du cadre génératif. (Source : article)
Les chercheurs ont évalué leur modèle en analysant divers aspects des propriétés des ligands cibles invisibles générés : stabilité de liaison, affinité, configuration géométrique, diversité et nouveauté.
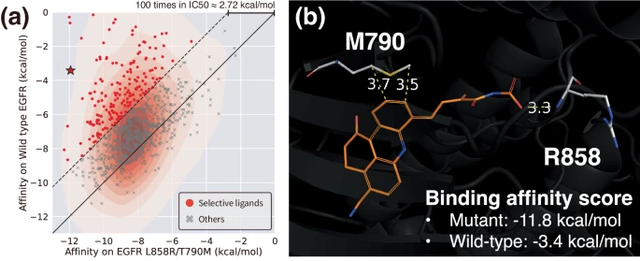
aIllustration : La modulation de la sélectivité via des interactions spécifiques au site contrôle la conception du ligand. (Source : article)
Les chercheurs ont utilisé ce modèle pour résoudre des problèmes pratiques dans lesquels des sites d'interaction spécifiques jouent un rôle essentiel, démontrant ainsi l'applicabilité de leur approche à la conception de médicaments basée sur la structure.
Lien papier :https://www.nature.com/articles/s41467-024-47011-2
Ce qui précède est le contenu détaillé de. pour plus d'informations, suivez d'autres articles connexes sur le site Web de PHP en chinois!

Outils d'IA chauds

Undresser.AI Undress
Application basée sur l'IA pour créer des photos de nu réalistes

AI Clothes Remover
Outil d'IA en ligne pour supprimer les vêtements des photos.

Undress AI Tool
Images de déshabillage gratuites

Clothoff.io
Dissolvant de vêtements AI

AI Hentai Generator
Générez AI Hentai gratuitement.

Article chaud

Outils chauds

Bloc-notes++7.3.1
Éditeur de code facile à utiliser et gratuit

SublimeText3 version chinoise
Version chinoise, très simple à utiliser

Envoyer Studio 13.0.1
Puissant environnement de développement intégré PHP

Dreamweaver CS6
Outils de développement Web visuel

SublimeText3 version Mac
Logiciel d'édition de code au niveau de Dieu (SublimeText3)
 Le robot DeepMind joue au tennis de table, et son coup droit et son revers glissent dans les airs, battant complètement les débutants humains
Aug 09, 2024 pm 04:01 PM
Le robot DeepMind joue au tennis de table, et son coup droit et son revers glissent dans les airs, battant complètement les débutants humains
Aug 09, 2024 pm 04:01 PM
Mais peut-être qu’il ne pourra pas vaincre le vieil homme dans le parc ? Les Jeux Olympiques de Paris battent leur plein et le tennis de table suscite beaucoup d'intérêt. Dans le même temps, les robots ont également réalisé de nouvelles avancées dans le domaine du tennis de table. DeepMind vient tout juste de proposer le premier agent robot apprenant capable d'atteindre le niveau des joueurs amateurs humains de tennis de table de compétition. Adresse papier : https://arxiv.org/pdf/2408.03906 Quelle est la capacité du robot DeepMind à jouer au tennis de table ? Probablement à égalité avec les joueurs amateurs humains : tant en coup droit qu'en revers : l'adversaire utilise une variété de styles de jeu, et le robot peut également résister : recevoir des services avec des tours différents : Cependant, l'intensité du jeu ne semble pas aussi intense que le vieil homme dans le parc. Pour les robots, le tennis de table
 La première griffe mécanique ! Yuanluobao est apparu à la World Robot Conference 2024 et a lancé le premier robot d'échecs pouvant entrer dans la maison
Aug 21, 2024 pm 07:33 PM
La première griffe mécanique ! Yuanluobao est apparu à la World Robot Conference 2024 et a lancé le premier robot d'échecs pouvant entrer dans la maison
Aug 21, 2024 pm 07:33 PM
Le 21 août, la Conférence mondiale sur les robots 2024 s'est tenue en grande pompe à Pékin. La marque de robots domestiques de SenseTime, "Yuanluobot SenseRobot", a dévoilé toute sa famille de produits et a récemment lancé le robot de jeu d'échecs Yuanluobot AI - Chess Professional Edition (ci-après dénommé "Yuanluobot SenseRobot"), devenant ainsi le premier robot d'échecs au monde pour le maison. En tant que troisième produit robot jouant aux échecs de Yuanluobo, le nouveau robot Guoxiang a subi un grand nombre de mises à niveau techniques spéciales et d'innovations en matière d'IA et de machines d'ingénierie. Pour la première fois, il a réalisé la capacité de ramasser des pièces d'échecs en trois dimensions. grâce à des griffes mécaniques sur un robot domestique et effectuer des fonctions homme-machine telles que jouer aux échecs, tout le monde joue aux échecs, réviser la notation, etc.
 Claude aussi est devenu paresseux ! Internaute : apprenez à vous accorder des vacances
Sep 02, 2024 pm 01:56 PM
Claude aussi est devenu paresseux ! Internaute : apprenez à vous accorder des vacances
Sep 02, 2024 pm 01:56 PM
La rentrée scolaire est sur le point de commencer, et ce ne sont pas seulement les étudiants qui sont sur le point de commencer le nouveau semestre qui doivent prendre soin d’eux-mêmes, mais aussi les grands modèles d’IA. Il y a quelque temps, Reddit était rempli d'internautes se plaignant de la paresse de Claude. « Son niveau a beaucoup baissé, il fait souvent des pauses et même la sortie devient très courte. Au cours de la première semaine de sortie, il pouvait traduire un document complet de 4 pages à la fois, mais maintenant il ne peut même plus produire une demi-page. !" https://www.reddit.com/r/ClaudeAI/comments/1by8rw8/something_just_feels_wrong_with_claude_in_the/ dans un post intitulé "Totalement déçu par Claude", plein de
 Lors de la World Robot Conference, ce robot domestique porteur de « l'espoir des futurs soins aux personnes âgées » a été entouré
Aug 22, 2024 pm 10:35 PM
Lors de la World Robot Conference, ce robot domestique porteur de « l'espoir des futurs soins aux personnes âgées » a été entouré
Aug 22, 2024 pm 10:35 PM
Lors de la World Robot Conference qui se tient à Pékin, l'exposition de robots humanoïdes est devenue le centre absolu de la scène. Sur le stand Stardust Intelligent, l'assistant robot IA S1 a réalisé trois performances majeures de dulcimer, d'arts martiaux et de calligraphie. un espace d'exposition, capable à la fois d'arts littéraires et martiaux, a attiré un grand nombre de publics professionnels et de médias. Le jeu élégant sur les cordes élastiques permet au S1 de démontrer un fonctionnement fin et un contrôle absolu avec vitesse, force et précision. CCTV News a réalisé un reportage spécial sur l'apprentissage par imitation et le contrôle intelligent derrière "Calligraphy". Le fondateur de la société, Lai Jie, a expliqué que derrière les mouvements soyeux, le côté matériel recherche le meilleur contrôle de la force et les indicateurs corporels les plus humains (vitesse, charge). etc.), mais du côté de l'IA, les données réelles de mouvement des personnes sont collectées, permettant au robot de devenir plus fort lorsqu'il rencontre une situation forte et d'apprendre à évoluer rapidement. Et agile
 Annonce des prix ACL 2024 : l'un des meilleurs articles sur le déchiffrement Oracle par HuaTech, GloVe Time Test Award
Aug 15, 2024 pm 04:37 PM
Annonce des prix ACL 2024 : l'un des meilleurs articles sur le déchiffrement Oracle par HuaTech, GloVe Time Test Award
Aug 15, 2024 pm 04:37 PM
Les contributeurs ont beaucoup gagné de cette conférence ACL. L'ACL2024, d'une durée de six jours, se tient à Bangkok, en Thaïlande. ACL est la plus grande conférence internationale dans le domaine de la linguistique informatique et du traitement du langage naturel. Elle est organisée par l'Association internationale pour la linguistique informatique et a lieu chaque année. L'ACL s'est toujours classée première en termes d'influence académique dans le domaine de la PNL, et c'est également une conférence recommandée par le CCF-A. La conférence ACL de cette année est la 62e et a reçu plus de 400 travaux de pointe dans le domaine de la PNL. Hier après-midi, la conférence a annoncé le meilleur article et d'autres récompenses. Cette fois, il y a 7 Best Paper Awards (deux inédits), 1 Best Theme Paper Award et 35 Outstanding Paper Awards. La conférence a également décerné 3 Resource Paper Awards (ResourceAward) et Social Impact Award (
 Hongmeng Smart Travel S9 et conférence de lancement de nouveaux produits avec scénario complet, un certain nombre de nouveaux produits à succès ont été lancés ensemble
Aug 08, 2024 am 07:02 AM
Hongmeng Smart Travel S9 et conférence de lancement de nouveaux produits avec scénario complet, un certain nombre de nouveaux produits à succès ont été lancés ensemble
Aug 08, 2024 am 07:02 AM
Cet après-midi, Hongmeng Zhixing a officiellement accueilli de nouvelles marques et de nouvelles voitures. Le 6 août, Huawei a organisé la conférence de lancement de nouveaux produits Hongmeng Smart Xingxing S9 et Huawei, réunissant la berline phare intelligente panoramique Xiangjie S9, le nouveau M7Pro et Huawei novaFlip, MatePad Pro 12,2 pouces, le nouveau MatePad Air, Huawei Bisheng With de nombreux nouveaux produits intelligents tous scénarios, notamment la série d'imprimantes laser X1, FreeBuds6i, WATCHFIT3 et l'écran intelligent S5Pro, des voyages intelligents, du bureau intelligent aux vêtements intelligents, Huawei continue de construire un écosystème intelligent complet pour offrir aux consommateurs une expérience intelligente du Internet de tout. Hongmeng Zhixing : Autonomisation approfondie pour promouvoir la modernisation de l'industrie automobile intelligente Huawei s'associe à ses partenaires de l'industrie automobile chinoise pour fournir
 L'équipe de Li Feifei a proposé ReKep pour donner aux robots une intelligence spatiale et intégrer GPT-4o
Sep 03, 2024 pm 05:18 PM
L'équipe de Li Feifei a proposé ReKep pour donner aux robots une intelligence spatiale et intégrer GPT-4o
Sep 03, 2024 pm 05:18 PM
Intégration profonde de la vision et de l'apprentissage des robots. Lorsque deux mains de robot travaillent ensemble en douceur pour plier des vêtements, verser du thé et emballer des chaussures, associées au robot humanoïde 1X NEO qui a fait la une des journaux récemment, vous pouvez avoir le sentiment : nous semblons entrer dans l'ère des robots. En fait, ces mouvements soyeux sont le produit d’une technologie robotique avancée + d’une conception de cadre exquise + de grands modèles multimodaux. Nous savons que les robots utiles nécessitent souvent des interactions complexes et exquises avec l’environnement, et que l’environnement peut être représenté comme des contraintes dans les domaines spatial et temporel. Par exemple, si vous souhaitez qu'un robot verse du thé, le robot doit d'abord saisir la poignée de la théière et la maintenir verticalement sans renverser le thé, puis la déplacer doucement jusqu'à ce que l'embouchure de la théière soit alignée avec l'embouchure de la tasse. , puis inclinez la théière selon un certain angle. ce
 Conférence sur l'intelligence artificielle distribuée Appel à communications DAI 2024 : Agent Day, Richard Sutton, le père de l'apprentissage par renforcement, sera présent ! Yan Shuicheng, Sergey Levine et les scientifiques de DeepMind prononceront des discours d'ouverture
Aug 22, 2024 pm 08:02 PM
Conférence sur l'intelligence artificielle distribuée Appel à communications DAI 2024 : Agent Day, Richard Sutton, le père de l'apprentissage par renforcement, sera présent ! Yan Shuicheng, Sergey Levine et les scientifiques de DeepMind prononceront des discours d'ouverture
Aug 22, 2024 pm 08:02 PM
Introduction à la conférence Avec le développement rapide de la science et de la technologie, l'intelligence artificielle est devenue une force importante dans la promotion du progrès social. À notre époque, nous avons la chance d’être témoins et de participer à l’innovation et à l’application de l’intelligence artificielle distribuée (DAI). L’intelligence artificielle distribuée est une branche importante du domaine de l’intelligence artificielle, qui a attiré de plus en plus d’attention ces dernières années. Les agents basés sur de grands modèles de langage (LLM) ont soudainement émergé. En combinant les puissantes capacités de compréhension du langage et de génération des grands modèles, ils ont montré un grand potentiel en matière d'interaction en langage naturel, de raisonnement par connaissances, de planification de tâches, etc. AIAgent reprend le grand modèle de langage et est devenu un sujet brûlant dans le cercle actuel de l'IA. Au





