

新しい人工知能アプリケーションは、研究者が医薬品開発能力を向上させるのに役立ちます。
このプロジェクトは TopoFormer と呼ばれ、ミシガン州立大学数学学部の Guowei Wei 教授が率いる学際的なチームによって開発されました。
TopoFormer は、分子の 3 次元情報を、一般的な AI ベースの薬物相互作用モデルで使用できるデータに変換し、これらのモデルの薬物有効性を予測する能力を拡張します。
「人工知能を使えば、創薬をより速く、より効率的に、より安価に行うことができます」と、生化学・分子生物学科と電気・コンピュータ工学科の教員でもあるウェイ氏は語った。
ウェイ教授は、米国では薬の開発には約10年かかり、約20億ドルの費用がかかると説明しました。その時間の約半分は薬剤の治験に費やされ、残りの半分は試験する新しい治療法候補の発見に費やされます。
TopoFormer は開発時間を短縮する可能性があります。このようにして、医薬品開発コストを削減し、それによって下流の消費者にとっての医薬品価格を下げることができます。
この研究は「タンパク質-リガンド相互作用予測のためのマルチスケールトポロジー対応の構造から配列への変換」というタイトルで、2024年6月24日に「Nature Machine Intelligence」に掲載されました。

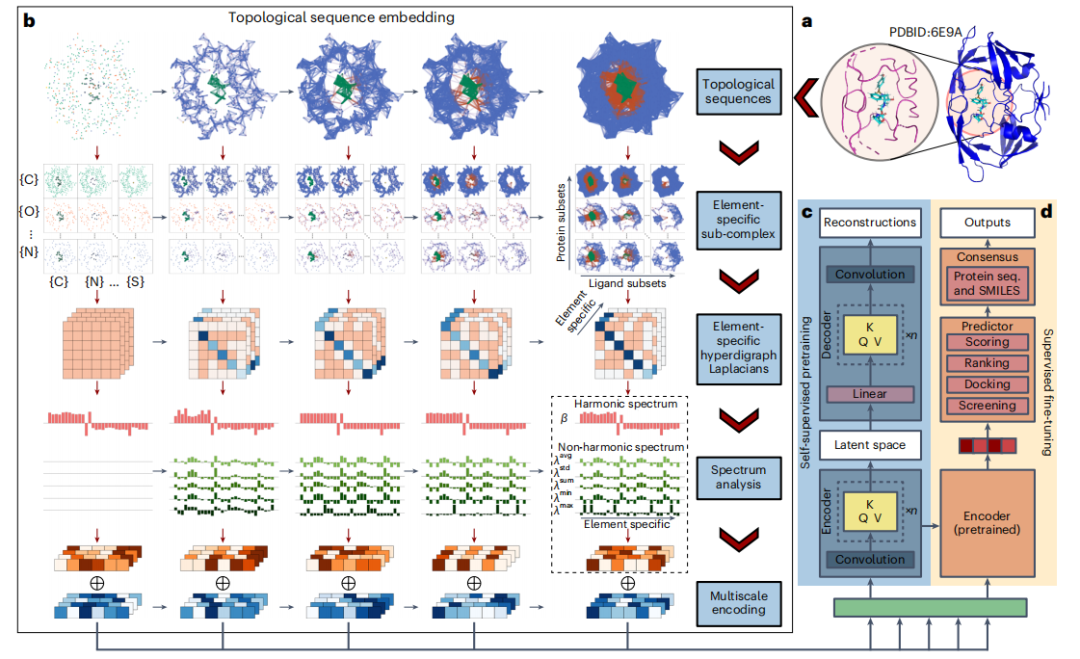 図: TopoFormer モデル全体の概略図。 (出典: 論文)
図: TopoFormer モデル全体の概略図。 (出典: 論文)
このアプローチにより、さまざまな次元の有向ハイパーエッジを使用して、単純なペア接続を超えた複雑な相互作用をモデル化できます。さらに、これらのエッジの方向は、電気陰性度やイオン化エネルギーなどの物理的および化学的特性を組み合わせて、従来の方法よりも微妙な表現を提供します。研究者らは、有向ハイパーエッジで 2 つの B7C2H9 異性体を区別することでこの能力を実証し、この方法が元素配置を効果的に区別できることを実証しました。
タンパク質-リガンド複合体を研究する場合、研究者はトポロジカル超有向グラフを初期表現として採用し、PTHL理論でさらに強化して幾何学的およびトポロジカルな特性を分析します。
研究者らは、ゼロ次元のホッホ・ラプラシアン演算子が明確に定義された量子系のハミルトニアンの運動エネルギー演算子にリンクされている分子構造などの物理系からインスピレーションを得て、トポロジカル・スーパーへの離散アナロジーをグラフに拡張しました。ラプラシアン行列のこれらの固有値は、物理システムのエネルギー スペクトルに似た、トポロジカル オブジェクトの特性についての洞察を提供します。
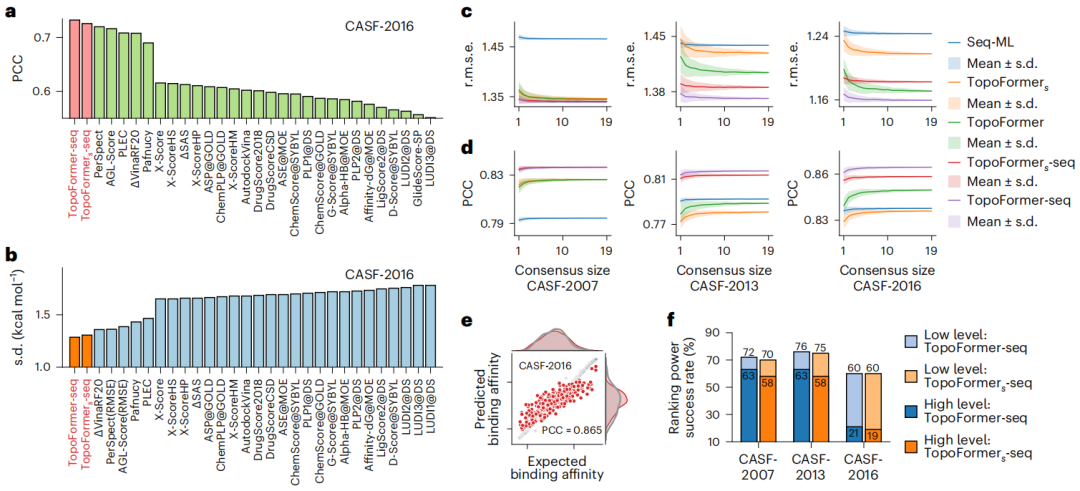
従来の永続的相同性と比較して、PTHL メソッドは、単体複合体を超えた広範囲の構造を分析することで大きな進歩を遂げています。永続的なラプラシアン演算子の非調和スペクトルを通じて、Betti 数やホモトピック形状進化などの基本的な相同性情報と幾何学的な洞察を取得します。
分析結果は、従来の相同性と比較して、より包括的な特徴付けを提供することを示しています。ラプラシアン演算子のゼロ固有値の多重度 (ベティ数に相当) は、この方法にバーコード情報が含まれていることを確認し、タンパク質-リガンド複合体を理解するための強力なフレームワークを提供します。
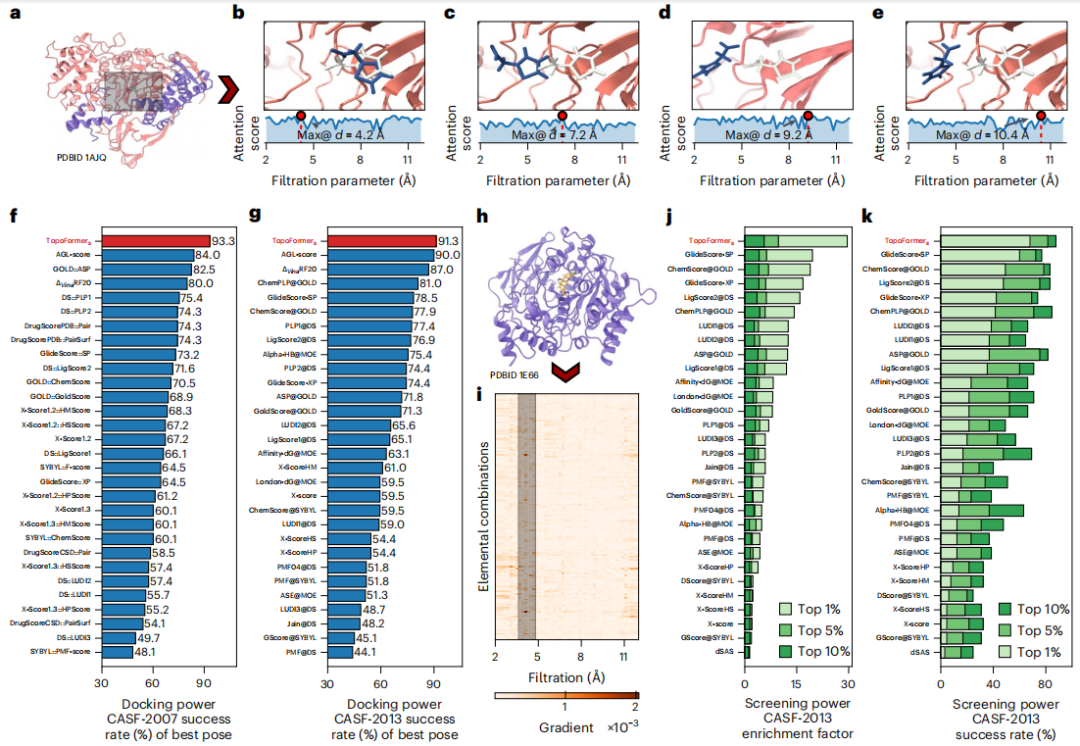
共有結合力、イオン力、ファンデルワールス力など、タンパク質-リガンド複合体における複雑な原子相互作用を捉えるために、研究者らは PTHL を使用してマルチスケール解析を実行しました。このアプローチでは、フィルタリング パラメーターに基づいてトポロジカル シーケンスを展開することで、スケール間の相互作用を調べることができます。これにより、Transformer モデルが結合親和性などのプロパティに各スケールが置く重みを特定するのに役立ちます。
水素結合、ファンデルワールス力、πスタッキングなどの元素相互作用は、タンパク質-リガンド複合体の安定性と特異性の基礎です。これらの相互作用を元素レベルで分析するために、研究者らはトポロジカルシーケンス埋め込みにおける元素固有の分析を導入しました。
このメソッドは、タンパク質とリガンドの共通の重元素に基づいてサブハイパーグラフを構築し、複合体内の相互作用をコード化する元素固有のラプラシアン行列を生成します。このテクノロジーは、タンパク質とリガンドの相互作用における複雑なダイナミクスに対する Transformer モデルの理解を強化する詳細な物理的および化学的特徴を抽出します。
結論
要約すると、TopoFormer は、ある形式の情報を読み取り、それを別の形式に変換するように訓練されています。この場合、タンパク質と薬物がその形状に基づいてどのように相互作用するかについての 3 次元情報を取得し、それを現在のモデルが理解できる 1 次元情報に再構築します。
新しいモデルは、何万ものタンパク質と薬物の相互作用でトレーニングされており、2 つの分子間の各相互作用はコードまたは「単語」として記録されます。これらの単語をつなぎ合わせて薬物とタンパク質の複合体の説明を形成し、その形状の記録を作成します。
「こうすることで、たくさんの単語が文章のようにつながったものになります。」とウェイは言いました。
新しい薬物相互作用を予測する他のモデルは、これらの文を読み取り、より多くのコンテキストを提供できます。新薬が本だとしたら、TopoFormer は大まかなストーリーのアイデアを完全なプロットに変換し、すぐに書くことができます。
論文リンク: https://www.nature.com/articles/s42256-024-00855-1
関連レポート: https://phys.org/news/2024-06-drug-discovery-ai-3d -typic.html
以上がNature サブジャーナルに掲載されたトポロジカル Transformer モデルは、医薬品開発を支援するマルチスケールのタンパク質-リガンド相互作用を予測しますの詳細内容です。詳細については、PHP 中国語 Web サイトの他の関連記事を参照してください。