

Dalam kehidupan, mudah untuk menghidupkan lampu atau melaraskan lampu. Tetapi sistem yang mencapai kawalan serupa terhadap fungsi biomolekul adalah kompleks dan kurang difahami.
Dalam biologi, fungsi protein dihidupkan dan dimatikan dengan cara yang kompleks Regulasi allosterik ialah salah satu mekanisme pengawalseliaan biologi yang penting dan penting untuk metabolisme yang sihat dan isyarat sel. Tetapi mencipta aloi dalam sistem protein sintetik sentiasa memberikan cabaran yang ketara.
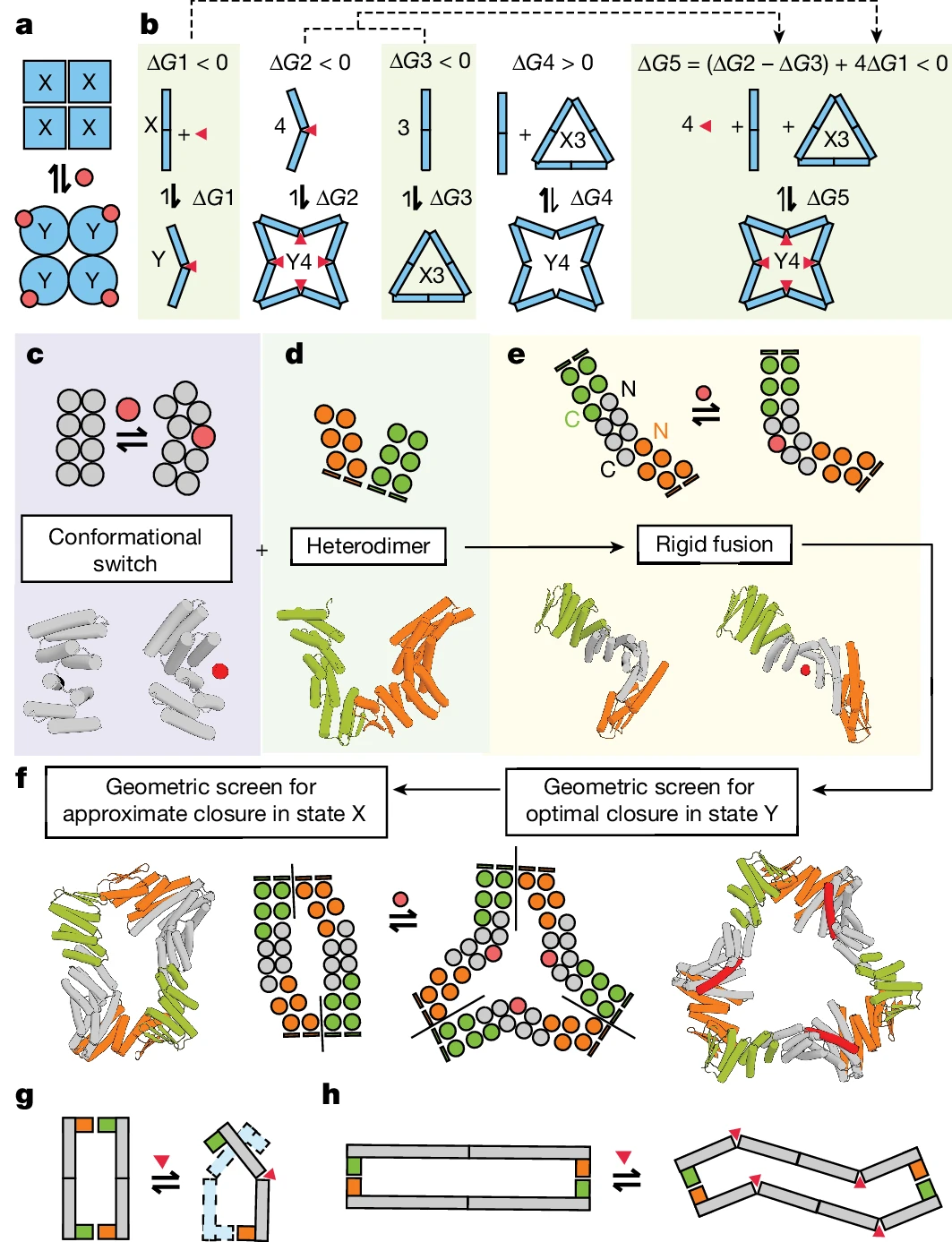
Baru-baru ini, pasukan David Baker di University of Washington mereka bentuk protein yang boleh bertukar antara pemasangan dan pembongkaran dengan pasti dan tepat melalui kawalan allosterik. Penyelidik telah menggunakan AI untuk mereka bentuk protein baharu yang tidak wujud dalam alam semula jadi, mereka bentuk pelbagai susunan protein dinamik.
David Baker berkata: "Dengan mereka bentuk protein yang boleh dipasang dan dibongkar atas arahan, kami membuka jalan untuk bioteknologi masa depan yang mungkin menandingi kerumitan alam semula jadi." Arvind Pillai, pengarang pertama dan pengarang kertas yang sepadan, berkata: "Salah satu daripada inovasi utama kajian ini ialah reka bentuk himpunan protein yang boleh bertukar antara keadaan oligomer yang berbeza, seperti dimer. , cincin dan sangkar sebagai tindak balas kepada molekul effector. , keupayaan untuk mengawal struktur protein dari jauh ini membuka kemungkinan untuk membangunkan biomaterial adaptif dan sistem penyampaian ubat Satu kejayaan yang menakjubkan dalam reka bentuk.
Penyelidikan berkaitan bertajuk "De novo design of allosterically switchable protein assemblies" dan diterbitkan dalam "Nature" pada 14 Ogos.
Allostery dan reka bentuk de novoPautan kertas: https://www.nature.com/articles/s41586-024-07813-2#🎜 🎜 #
De novo reka bentuk protein mengembangkan repertoir sifat yang berkembang secara semula jadi, membuka pintu kepada kawalan fungsi protein yang lebih terkawal.
Diinspirasikan oleh model kerjasama MWC, penyelidik boleh bertukar melalui badan tegar Modul engsel dan antara muka protein untuk mereka bentuk dari awal
allosterikGunakan model MWC sebagai titik permulaan untuk reka bentuk
Ilustrasi: Reka bentuk pemasangan kitaran yang dikawal secara alosterik. (Sumber: kertas)
Para penyelidik mensintesis beberapa protein yang direka bentuk dan kemudian mencirikan tingkah laku pensuisan yang disebabkan oleh struktur protein dan pengikatan molekul effector. Hampir 40% daripada protein sintetik yang direka untuk bertukar antara pemasangan cincin yang terdiri daripada bilangan protomer yang berbeza-beza adalah larut air dan memaparkan stoikiometri protomer yang dijangkakan. Tambahan pula, bilangan efektor yang terikat pada protein mengikut model MWC: semua tapak pengikatan diisi, atau tiada langsung. Dalam erti kata lain, pengikatan efektor homolog sangat kooperatif dan pemasangan yang terhasil tidak mengandungi campuran protomer R dan T.Abbildung: Ein Protein wechselt absichtlich zwischen Assemblierungszuständen. (Quelle: Nature)
Um noch einen Schritt weiter zu gehen, entwarfen die Forscher Proteine, die Doppelscharniere (zwei Scharniere, die durch kurze Schleifen verbunden sind) enthalten, mit dem Ziel, Strukturen zu schaffen, die auf die Bindung von Effektoren reagieren, ohne die Anzahl der Protomer in der Proteinanordnung zu verändern Das Protein verändert seine 3D-Struktur. Tatsächlich funktionierten diese Proteine wie erwartet und reproduzierten das dominante Verhalten natürlich vorkommender allosterischer Proteine wie Hämoglobin. Schließlich entwarfen die Forscher auch Protomere, die sich zusammensetzen oder zerlegen, wenn sie an Effektormoleküle gebunden sind.
Spezifische De-novo-Proteinanordnungen, die in der Studie entworfen wurden, umfassen Ringe, die durch die Dimerisierung zweier Monomere gebildet werden und beim Zusammenbau eine Lichtabgabe für Biosensoranwendungen auslösen, sowie käfigartige Strukturen, die einer kontrollierten Zerlegung unterliegen, um die Nutzlast für die Arzneimittelabgabe freizugeben. Diese Proteindynamik wurde experimentell in vitro durch Größenausschlusschromatographie, Massenspektrometrie und Elektronenmikroskopie verifiziert.
Pillai betonte, dass Ringstrukturen zusätzliche präzise Eigenschaften wie Kooperativität aufweisen, ein Phänomen, das natürliche Systeme (z. B. Blutproteine, Hämoglobin) aufweisen. In synergistischen Systemen verstärkt die Bindung eines Moleküls die Bindung anderer Moleküle und führt zu schnellen Ein-Aus-Reaktionen, die für eine präzise Steuerung entscheidend sind, beispielsweise das Einfangen von Sauerstoff in der Lunge und seine Freisetzung in das Gewebe.
„In der Vergangenheit haben wir im Labor viel getan, um die Bindungsaffinität einer Substanz zu kontrollieren, beispielsweise indem wir sie immer fester gebunden haben. Aber das ist nicht der einzige Aspekt, der für biologische Systeme relevant ist“, sagte Pillai. „Manchmal möchte man in der Lage sein, über einen sehr engen Konzentrationsbereich zu binden.“ Um das Design zu validieren, charakterisierten die Forscher mehr als 20 Proteinanordnungen mittels Negativfärbung und Kryo-Elektronenmikroskopie. „Dadurch konnten wir bestätigen, welche Designs sich wie erwartet bildeten, und beobachten, wie diese Anordnungen ihre Struktur veränderten, als Effektormoleküle eingeführt wurden“, erklärt Dr. Andrew Borst, Leiter des IPD Electron Microscopy Research Core.
Abbildung: Strukturcharakterisierung von sr312 und sr322 durch Elektronenmikroskopie. (Quelle: Papier) 
Zu den entworfenen Komponenten gehören nanoskalige Behälter, die aus der Ferne geöffnet und geschlossen werden können. Solche Systeme könnten zu neuartigen Medikamentenverabreichungsvehikeln mit fortschrittlichen Kontrollmechanismen führen, einschließlich Geräten, die zelltötende Medikamente binden, bis sie auf Tumore treffen.
Diese Forschung ebnet den Weg für die Gestaltung allosterisch kontrollierter Funktionen, die über den Auf- und Abbau von Proteinen hinausgehen, wie etwa die Regulierung der Enzymaktivität für Stoffwechselfunktionen und Nanomaschinen, die Energie in mechanische Arbeit umwandeln können, ähnlich den Proteinen, die für die Zellbewegung verantwortlich sind .
„Der nächste Schritt besteht darin, festzustellen, ob wir Wechselwirkungen mit kleinen Molekülen eingehen und Reaktionen präzise katalysieren können, was eine größere Herausforderung für das gesamte Gebiet darstellt“, sagte Pillai.
Zukünftig möchte das Forschungsteam die Dynamik dieser manipulierten Proteine in einem breiteren biologischen Kontext bewerten. Zukünftige Arbeiten umfassen die Installation dieser technischen Funktionen auf Zelloberflächen in Gewebekulturen, um wertvolle Werkzeuge für die Feedback-Kontrolle bei Therapeutika wie der adoptiven Zelltherapie bereitzustellen.
Referenzinhalt:
https://www.bakerlab.org/2024/08/14/morphing-protein-assemblies-by-design/Atas ialah kandungan terperinci AI mereka bentuk 'suis' protein dari awal, satu kejayaan menakjubkan dalam reka bentuk protein, penyelidikan David Baker diterbitkan dalam Nature. Untuk maklumat lanjut, sila ikut artikel berkaitan lain di laman web China PHP!
 Apakah motor servo
Apakah motor servo
 Pengenalan kepada kaedah diagnostik SEO
Pengenalan kepada kaedah diagnostik SEO
 Apakah yang termasuk storan penyulitan data?
Apakah yang termasuk storan penyulitan data?
 Apakah perbezaan utama antara linux dan windows
Apakah perbezaan utama antara linux dan windows
 Memori yang boleh bertukar maklumat secara terus dengan CPU ialah a
Memori yang boleh bertukar maklumat secara terus dengan CPU ialah a
 Bagaimana untuk membuka fail mds
Bagaimana untuk membuka fail mds
 Tukar warna latar belakang perkataan kepada putih
Tukar warna latar belakang perkataan kepada putih
 Apakah alat pembangunan?
Apakah alat pembangunan?




