
深度學習方法推動了生物分子結構單態預測的重大進展。然而,生物分子的功能取決於它們可以呈現的構象範圍。對於勝肽來說尤其如此,勝肽是一類高度靈活的分子,參與多種生物過程,作為治療手段備受關注。
多倫多大學的 Philip M. Kim 和 Osama Abdin 開發了 PepFlow,這是一種可轉移生成模型,它能夠從輸入肽的允許構象空間中直接進行全原子採樣。研究人員在擴散框架中訓練模型,然後使用等效流進行構象採樣。
為了克服廣義全原子建模的成本過高,他們模組化了生成過程並整合了超網路來預測序列特定的網路參數。 PepFlow 可準確預測勝肽結構,並有效重現實驗勝肽集合,所需運行時間僅為傳統方法的一小部分。 PepFlow 也可用於對滿足大環化等約束的構形進行取樣。
「到目前為止,我們還無法模擬勝肽的全部構象。」這項研究的第一作者Osama Abdin 說道,「PepFlow 利用深度學習在幾分鐘內捕捉到勝肽的精確構象。該模型有可能透過設計作為黏合劑的勝肽來指導藥物開發。
 蛋白質-勝肽相互作用
蛋白質-勝肽相互作用
肽具有高特異性,毒性風險低。
Philip M. Kim 表示,PepFlow 模型專注於勝肽,因為它們是重要的生物分子,具有天然活性,需要模擬其構像以了解功能。
圖示:PepFlow 架構示意圖。 (資料來源:論文)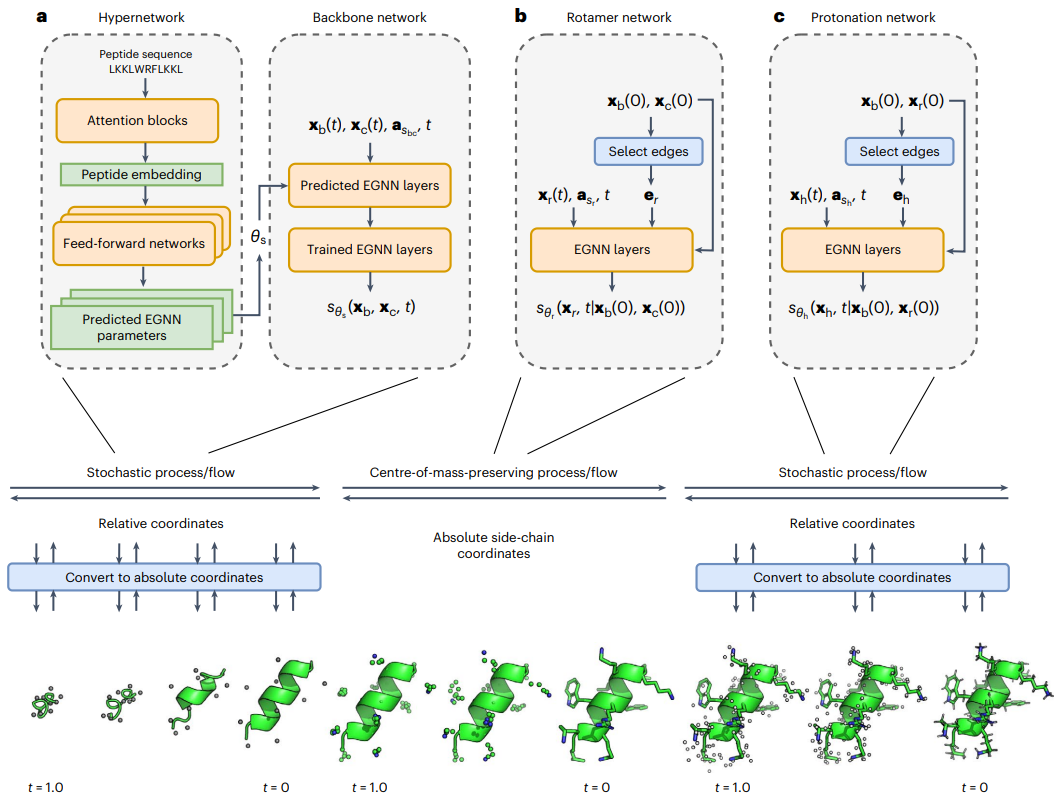
PepFlow 具有強大的預測單態勝肽結構和短線性基序集合 (SLiM) 的能力,並且可以透過潛在空間構象搜尋在諸如大環化等約束條件下對勝肽結構進行建模。
該模型擴展了領先的 Google Deepmind AI 系統 AlphaFold 預測蛋白質結構的能力。 PepFlow 可以產生給定勝肽的一系列構象,從而優於 AlphaFold2;當然 AlphaFold2 的設計初衷並不是解決這個問題。
PepFlow 的與眾不同之處在於背後的技術創新。例如,它是一種廣義模型,其靈感來自玻爾茲曼生成器,這是一種非常先進的基於物理的機器學習模型。
「使用PepFlow 建模可以深入了解勝肽的真實能量狀況。」Abdin 說,「開發PepFlow 花了兩年半的時間,訓練它只花了一個月的時間,但值得邁向下一個前沿,超越僅預測勝肽的一種結構的模型。勝肽對接方法通常從與目標蛋白對接的勝肽構象庫開始。更精確的勝肽集合生成也許能改善這個過程。
PepFlow 也可用於評估不同序列在目標蛋白質 - 蛋白質界面上呈現構象的傾向,進而可用於設計抑制勝肽。
圖示:PepFlow 產生的集合與分子動力學模擬的比較。 (資料來源:論文)雖然 PepFlow 在 AlphaFold2 的基礎上有所改進,但它本身也有局限性,因為這只是模型的第一個版本。 
PepFlow 有一個顯著缺點,與玻爾茲曼生成器不同,PepFlow 缺乏對生成的樣本重新加權以達到精確的玻爾茲曼分佈的能力。
雖然 PepFlow 能夠對產生的樣本進行似然計算,但可處理的計算需要使用隨機估計器,這會為計算值添加雜訊。此外,PepFlow 偶爾會產生高能量樣本,但無法捕捉分子動力學模擬中觀察到的全部能量景觀。
改進 PepFlow 的一個潛在方法是將開發的模型轉移到其他取樣框架。在條件設定中使用了標準化流,並使用了不同的取樣方法,以促進從玻爾茲曼分佈中進行取樣。
最近學界發展的流匹配範式,進一步作為以無模擬方式訓練連續規範化流模型的替代方法。流動匹配已被有效用於不同分子(包括小分子和蛋白質)的結構採樣,並可潛在地用於擴展 PepFlow 框架的有效性。
總之,PepFlow 的設計目標是易於擴展,以考慮其他因素、新資訊和潛在用途。
即使只是第一個版本,PepFlow 也是一個全面而有效的模型,具有進一步開發依賴肽結合來激活或抑制生物過程的治療方法的潛力。
論文連結:https://www.nature.com/articles/s42256-024-00860-4
相關報告:https://phys.org/news/2024-06-deep-outperforms-google-ai -peptide.html
以上是Nature子刊,優於AlphaFold,全原子採樣,一種預測勝肽結構的AI方法的詳細內容。更多資訊請關注PHP中文網其他相關文章!




