
在生活中,打開一盞燈或調節燈光很容易。但實現類似生物分子功能控制的系統卻非常複雜,而且人們對此了解甚少。
在生物學中,蛋白質功能以複雜的方式開啟和關閉,變構調節是其中一種重要的生物學調節機制,對於健康的新陳代謝和細胞信號傳導至關重要。但在合成蛋白質系統中,創建變構現像一直存在重大挑戰。
近日,華盛頓大學 David Baker 團隊,設計出了能夠透過變構控制,可靠且準確地在組裝和拆卸之間轉換的蛋白質。研究人員利用 AI 設計自然界中不存在的新蛋白質,設計了多種動態蛋白質排列。
David Baker 說:「透過設計,可以根據命令組裝和拆卸的蛋白質,我們為未來可能與自然界的複雜性相媲美的生物技術鋪平了道路。」
論文第一作者兼通訊作者Arvind Pillai說:「這項研究的關鍵創新之一是蛋白質組裝體的設計,這些蛋白質組裝體可以在不同的寡聚體狀態之間切換,如二聚體、環和籠子,以響應效應分子,這種遠端控制蛋白質結構的能力為開發自適應生物材料和藥物傳輸系統開闢了可能性。
相關研究以「De novo design of allosterically switchable protein assemblies」為題,於 8 月 14 日發佈在《Nature》上。
變構現象與從頭設計
從頭設計
啟發靈感:Monod-Wyman-Changeux (MWC) 協同模型
設計策略
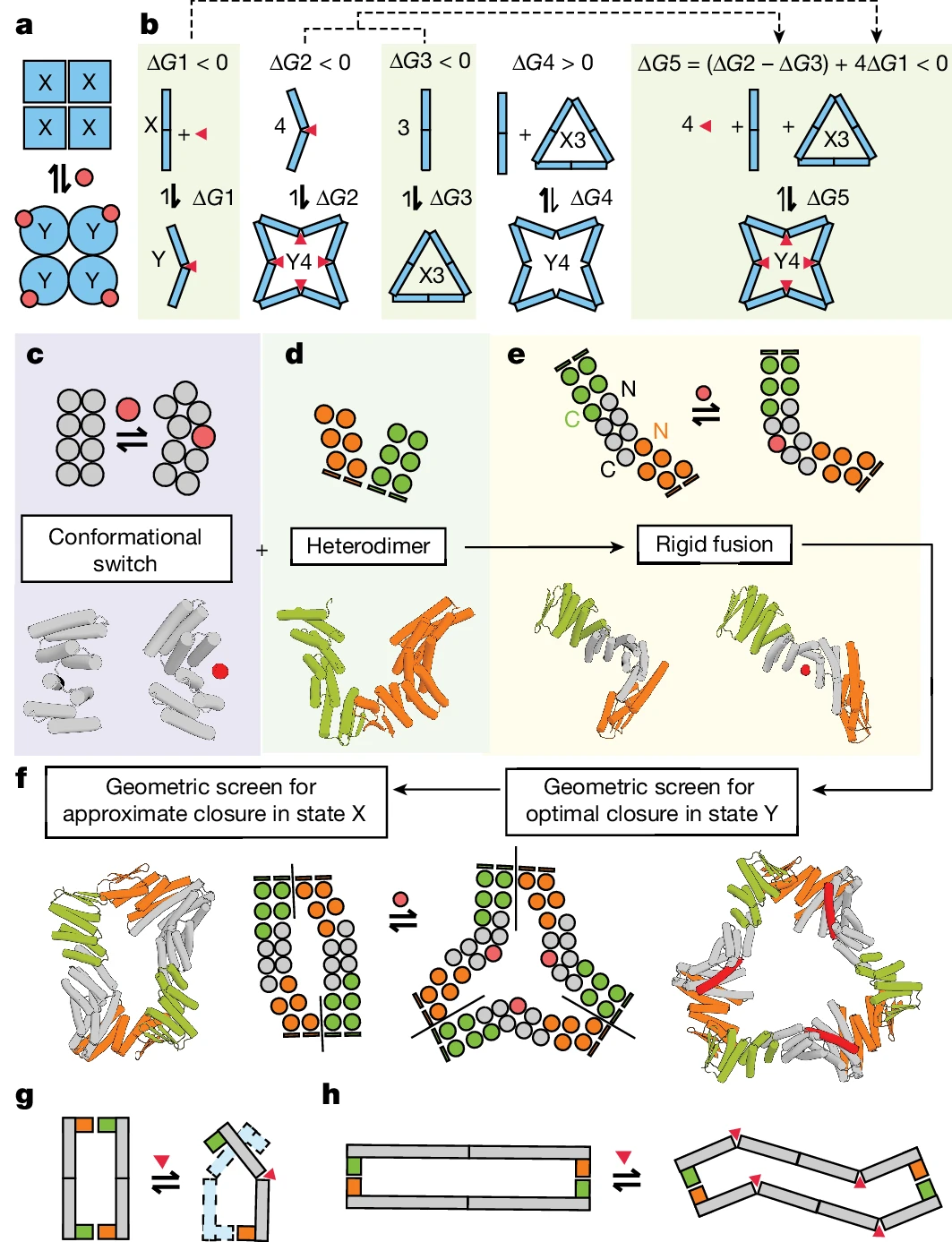
研究人員展示了 RFdiffusion、ProteinMPNN 和其他設計工具的應用,用於創建一系列動態且可變構切換的蛋白質組裝體。透過結合雙態鉸鍊和定制的蛋白質-蛋白質相互作用模組,生成的組裝體與先前所見的任何組裝體都大相徑庭,從而擴展了合成生物學的可能性。
關鍵創新:該研究的一個關鍵創新是蛋白質組裝體的設計。除了結構多功能性之外,團隊還實現了新蛋白質與其效應物之間的高親和力結合,確保了可靠的程序化變構控制。
效應物選擇:「對於這個項目,我們使用特定的勝肽作為效應物,但任何類型的分子都可以在適當的條件下產生蛋白質變構,」共同作者、華盛頓大學研究生Abbas Idris補充道。
圖示:變構控制環狀組裝體的設計。 (資料來源:論文)
此外,與蛋白質結合的效應物數量遵循 MWC 模型:所有結合位點都被填滿,或者根本沒有。換句話說,同源效應物結合是高度協同的,且產生的組裝體不包含 R 和 T 原聚體的混合物。
図: タンパク質は設計により集合状態を切り替えます。 (出典: Nature)
さらに一歩進んで、研究者らは、タンパク質集合体内のプロトマーの数を変えることなくエフェクター結合に応答する構造を作成することを目的として、二重ヒンジ (短いループで接続された 2 つのヒンジ) を含むタンパク質を設計しました。タンパク質はその 3D 構造を変化させます。案の定、これらのタンパク質は予想どおりに機能し、ヘモグロビンなどの天然に存在するアロステリックタンパク質の支配的な挙動を再現しました。最後に、研究者らは、エフェクター分子に結合すると組み立てたり分解したりするプロトマーも設計した。研究で設計された特定のde novoタンパク質集合体には、2つのモノマーの二量体化によって形成されたリング(集合時にバイオセンシング用途のための光出力をトリガーする)と、薬物送達のためにペイロードを放出するために制御された分解を受けるケージ状構造が含まれます。これらのタンパク質の動態は、サイズ排除クロマトグラフィー、質量分析法、電子顕微鏡法によって in vitro で実験的に検証されました。
ピライ氏は、環構造は協同性など、自然系(血液タンパク質、ヘモグロビンなど)が示す現象である付加的な正確な特性を示すことを強調しました。相乗的システムでは、1 つの分子の結合が他の分子の結合を強化し、肺で酸素を捕捉して組織に放出するなど、正確な制御に不可欠な迅速なオンオフ反応を引き起こします。
「歴史的に、研究室では、物質をより強く結合させるなど、物質の結合親和性を制御するために多くのことを行ってきました。しかし、生物学的システムに関連する側面はそれだけではありません」とピライ氏は言う。 「場合によっては、非常に狭い濃度範囲で結合できるようにしたいことがあります。」 設計を検証するために、研究者らはネガティブ染色と低温電子顕微鏡を使用して 20 以上のタンパク質集合体の特徴を調べました。 「これにより、どの設計が予想どおりに形成されたかを確認し、エフェクター分子が導入されたときにこれらの集合体がどのように構造を変化させるかを観察することができました」とIPD電子顕微鏡研究コアの責任者であるアンドリュー・ボースト博士は説明します。
図: 電子顕微鏡による sr312 と sr322 の構造特性評価。 (出典: 論文)この研究では、エフェクター結合部位と集合界面の間のアロステリック結合が、原子の観点からすると非常に長い距離である 1 ナノメートルを超える距離にわたって観察されました。この広範な結合は、自然を模倣し、場合によっては自然を超える複雑なタンパク質の挙動を作り出すために重要です。 
設計されたコンポーネントには、遠隔から開閉できるナノスケールのコンテナが含まれています。このようなシステムは、腫瘍に遭遇するまで細胞を殺す薬剤を隔離する装置など、高度な制御機構を備えた新しい薬剤送達媒体につながる可能性がある。この研究は、細胞運動を担うタンパク質と同様に、代謝機能の酵素活性の制御や、エネルギーを機械的仕事に変換できるナノマシンなど、タンパク質の組み立てと分解を超えたアロステリックに制御される機能の設計への道を切り開きます。 。 「次のステップは、小分子と相互作用を形成し、反応を正確に触媒できるかどうかを判断することです。これは、この分野全体にとってより挑戦的なフロンティアです」とピライ氏は語った。
今後、研究チームは、より広範な生物学的文脈において、これらの人工タンパク質の動態を評価することを目指しています。将来の研究には、組織培養の細胞表面にこれらの操作された機能をインストールし、養子細胞療法などの治療におけるフィードバック制御のための貴重なツールを提供することが含まれます。
参考コンテンツ:
https://www.bakerlab.org/2024/08/14/morphing-protein-assemblies-by-design/https://www.genengnews.com/topics/artificial- Intelligence/ai-designed-proteins-morph-on-demand-for-steerable-functionity/https://www.nature.com/articles/d41586-024-02242-7以上是AI從頭設計蛋白質「開關」,蛋白質設計的驚人突破,David Baker研究登Nature的詳細內容。更多資訊請關注PHP中文網其他相關文章!




