Nature子刊,优于AlphaFold,全原子采样,一种预测肽结构的AI方法

深度学习方法推动了生物分子结构单态预测的重大进展。然而,生物分子的功能取决于它们可以呈现的构象范围。对于肽来说尤其如此,肽是一类高度灵活的分子,参与多种生物过程,作为治疗手段备受关注。
多伦多大学的 Philip M. Kim 和 Osama Abdin 开发了 PepFlow,这是一种可转移生成模型,它能够从输入肽的允许构象空间中直接进行全原子采样。研究人员在扩散框架中训练模型,然后使用等效流进行构象采样。
为了克服广义全原子建模的成本过高,他们模块化了生成过程并集成了超网络来预测序列特定的网络参数。PepFlow 可准确预测肽结构,并有效重现实验肽集合,所需运行时间仅为传统方法的一小部分。PepFlow 还可用于对满足大环化等约束的构象进行采样。
「到目前为止,我们还无法模拟肽的全部构象。」这项研究的第一作者 Osama Abdin 说道,「PepFlow 利用深度学习在几分钟内捕捉到肽的精确构象。该模型有可能通过设计作为粘合剂的肽来指导药物开发。」
该研究以「Direct conformational sampling from peptide energy landscapes through hypernetwork-conditioned diffusion」为题,于 2024 年 6 月 27 日发布在《Nature Machine Intelligence》。

- 蛋白质-肽相互作用在分子通路中广泛存在,对细胞功能至关重要。
- 高达 40% 的蛋白质-蛋白质相互作用涉及肽结合。
- 肽通过结合球状蛋白质与无序区域的短序列发挥作用。
肽的治疗潜力
- 肽具有高特异性,毒性风险低。
- 与生物制剂相比,肽生产成本低,免疫原性弱。
- 肽疗法在医药市场份额不断扩大。
肽建模和工程设计
- Philip M. Kim 表示,PepFlow 模型专注于肽,因为它们是重要的生物分子,具有天然活性,需要模拟其构象以了解功能。
- Philip M. Kim 和 Osama Abdin 提出了一种直接全原子采样肽构象的方法。
- 即使对于短肽,进行准确且有效的全原子采样也极具挑战性。
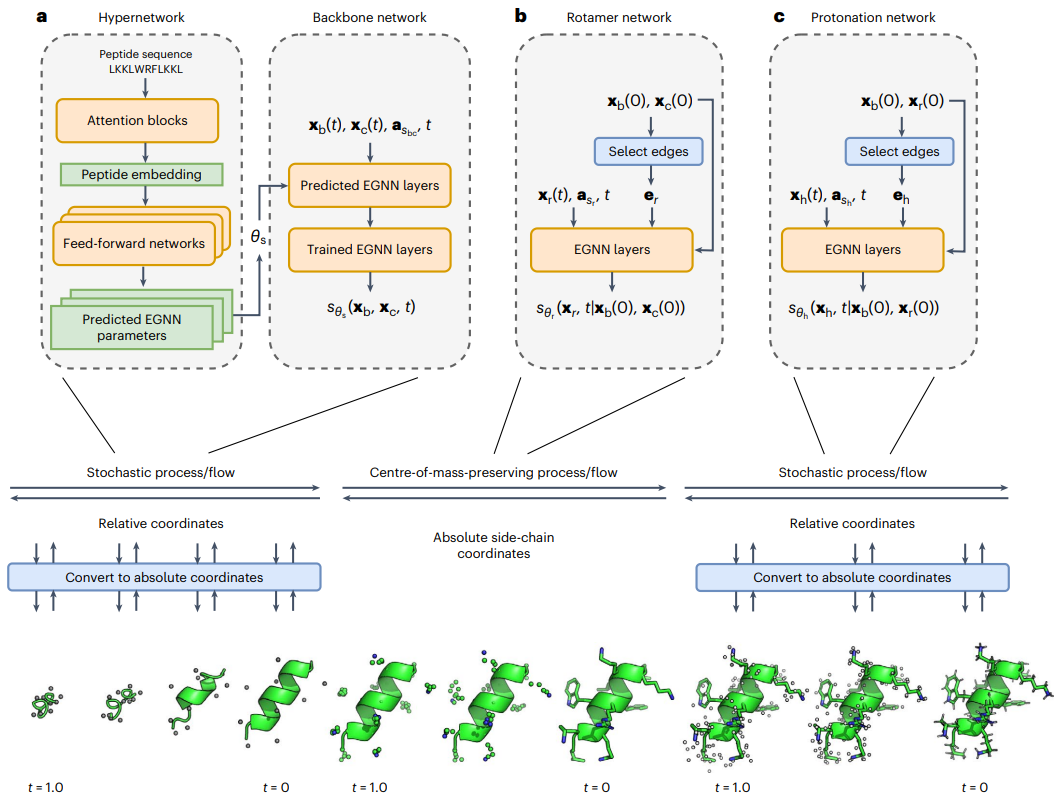
图示:PepFlow 架构示意图。(来源:论文)
为了解决这个问题,他们开发了 PepFlow,这是一个模块化、超网络条件的生成模型,可以预测任何输入肽序列的全原子构象。PepFlow 是在已知分子构象上进行训练的连续时间扩散模型。相应的概率流 ODE 则用于能量采样和训练。
PepFlow 具有强大的预测单态肽结构和短线性基序集合 (SLiM) 的能力,并且可以通过潜在空间构象搜索在诸如大环化等约束条件下对肽结构进行建模。
该模型扩展了领先的 Google Deepmind AI 系统 AlphaFold 预测蛋白质结构的能力。PepFlow 可以生成给定肽的一系列构象,从而优于 AlphaFold2;当然 AlphaFold2 的设计初衷并不是解决这一问题。
PepFlow 的与众不同之处在于其背后的技术创新。例如,它是一种广义模型,其灵感来自玻尔兹曼生成器,这是一种非常先进的基于物理的机器学习模型。
「使用 PepFlow 建模可以深入了解肽的真实能量状况。」Abdin 说,「开发 PepFlow 花了两年半的时间,训练它只花了一个月的时间,但值得迈向下一个前沿,超越仅预测肽的一种结构的模型。」
整体而言,准确高效地对肽构象进行采样的能力有可能改善肽对接和设计。肽对接方法通常从与目标蛋白对接的肽构象库开始。更精确的肽集合生成也许能改善这一过程。
PepFlow 还可用于评估不同序列在目标蛋白质 - 蛋白质界面上呈现构象的倾向,进而可用于设计抑制肽。

虽然 PepFlow 在 AlphaFold2 的基础上有所改进,但它本身也有局限性,因为这只是模型的第一个版本。
PepFlow 有一个显着缺点,与玻尔兹曼生成器不同,PepFlow 缺乏对生成的样本重新加权以达到精确的玻尔兹曼分布的能力。
虽然 PepFlow 能够对生成的样本进行似然计算,但可处理的计算需要使用随机估计器,这会给计算值添加噪声。此外,PepFlow 偶尔会生成高能样本,但无法捕获分子动力学模拟中观察到的全部能量景观。
改进 PepFlow 的一个潜在方法是将开发的模型转移到其他采样框架。在条件设置中使用了标准化流,并使用了不同的采样方法,以促进从玻尔兹曼分布中进行采样。
最近学界开发的流匹配范式,进一步作为以无模拟方式训练连续规范化流模型的替代方法。流动匹配已被有效用于不同分子(包括小分子和蛋白质)的结构采样,并可潜在地用于扩展 PepFlow 框架的有效性。
总之,PepFlow 的设计目标是易于扩展,以考虑其他因素、新信息和潜在用途。
即使只是第一个版本,PepFlow 也是一个全面而有效的模型,具有进一步开发依赖肽结合来激活或抑制生物过程的治疗方法的潜力。
论文链接:https://www.nature.com/articles/s42256-024-00860-4
相关报道:https://phys.org/news/2024-06-deep-outperforms-google-ai -peptide.html
以上是Nature子刊,优于AlphaFold,全原子采样,一种预测肽结构的AI方法的详细内容。更多信息请关注PHP中文网其他相关文章!

热AI工具

Undresser.AI Undress
人工智能驱动的应用程序,用于创建逼真的裸体照片

AI Clothes Remover
用于从照片中去除衣服的在线人工智能工具。

Undress AI Tool
免费脱衣服图片

Clothoff.io
AI脱衣机

Video Face Swap
使用我们完全免费的人工智能换脸工具轻松在任何视频中换脸!

热门文章

热工具

记事本++7.3.1
好用且免费的代码编辑器

SublimeText3汉化版
中文版,非常好用

禅工作室 13.0.1
功能强大的PHP集成开发环境

Dreamweaver CS6
视觉化网页开发工具

SublimeText3 Mac版
神级代码编辑软件(SublimeText3)
 DeepMind机器人打乒乓球,正手、反手溜到飞起,全胜人类初学者
Aug 09, 2024 pm 04:01 PM
DeepMind机器人打乒乓球,正手、反手溜到飞起,全胜人类初学者
Aug 09, 2024 pm 04:01 PM
但可能打不过公园里的老大爷?巴黎奥运会正在如火如荼地进行中,乒乓球项目备受关注。与此同时,机器人打乒乓球也取得了新突破。刚刚,DeepMind提出了第一个在竞技乒乓球比赛中达到人类业余选手水平的学习型机器人智能体。论文地址:https://arxiv.org/pdf/2408.03906DeepMind这个机器人打乒乓球什么水平呢?大概和人类业余选手不相上下:正手反手都会:对手采用多种打法,该机器人也能招架得住:接不同旋转的发球:不过,比赛激烈程度似乎不如公园老大爷对战。对机器人来说,乒乓球运动
 首配机械爪!元萝卜亮相2024世界机器人大会,发布首个走进家庭的国际象棋机器人
Aug 21, 2024 pm 07:33 PM
首配机械爪!元萝卜亮相2024世界机器人大会,发布首个走进家庭的国际象棋机器人
Aug 21, 2024 pm 07:33 PM
8月21日,2024世界机器人大会在北京隆重召开。商汤科技旗下家用机器人品牌“元萝卜SenseRobot”家族全系产品集体亮相,并最新发布元萝卜AI下棋机器人——国际象棋专业版(以下简称“元萝卜国象机器人”),成为全球首个走进家庭的国际象棋机器人。作为元萝卜的第三款下棋机器人产品,全新的国象机器人在AI和工程机械方面进行了大量专项技术升级和创新,首次在家用机器人上实现了通过机械爪拾取立体棋子,并进行人机对弈、人人对弈、记谱复盘等功能,
 Claude也变懒了!网友:学会给自己放假了
Sep 02, 2024 pm 01:56 PM
Claude也变懒了!网友:学会给自己放假了
Sep 02, 2024 pm 01:56 PM
开学将至,该收心的不止有即将开启新学期的同学,可能还有AI大模型。前段时间,Reddit上挤满了吐槽Claude越来越懒的网友。「它的水平下降了很多,经常停顿,甚至输出也变得很短。在发布的第一周,它可以一次性翻译整整4页文稿,现在连半页都输出不了了!」https://www.reddit.com/r/ClaudeAI/comments/1by8rw8/something_just_feels_wrong_with_claude_in_the/在一个名为「对Claude彻底失望了的帖子里」,满满地
 世界机器人大会上,这家承载「未来养老希望」的国产机器人被包围了
Aug 22, 2024 pm 10:35 PM
世界机器人大会上,这家承载「未来养老希望」的国产机器人被包围了
Aug 22, 2024 pm 10:35 PM
正在北京举行的世界机器人大会上,人形机器人的展示成为了现场绝对的焦点,在星尘智能的展台上,由于AI机器人助理S1在一个展区上演扬琴、武术、书法三台大戏,能文能武,吸引了大量专业观众和媒体的驻足。在带弹性的琴弦上的优雅演奏,让S1展现出速度、力度、精度兼具的精细操作和绝对掌控。央视新闻对「书法」背后的模仿学习和智能控制进行了专题报道,公司创始人来杰解释到,丝滑动作的背后,是硬件侧追求最好力控和最仿人身体指标(速度、负载等),而是在AI侧则采集人的真实动作数据,让机器人遇强则强,快速学习进化。而敏捷
 ACL 2024奖项公布:华科大破译甲骨文最佳论文之一、GloVe时间检验奖
Aug 15, 2024 pm 04:37 PM
ACL 2024奖项公布:华科大破译甲骨文最佳论文之一、GloVe时间检验奖
Aug 15, 2024 pm 04:37 PM
本届ACL大会,投稿者「收获满满」。为期六天的ACL2024正在泰国曼谷举办。ACL是计算语言学和自然语言处理领域的顶级国际会议,由国际计算语言学协会组织,每年举办一次。一直以来,ACL在NLP领域的学术影响力都位列第一,它也是CCF-A类推荐会议。今年的ACL大会已是第62届,接收了400余篇NLP领域的前沿工作。昨天下午,大会公布了最佳论文等奖项。此次,最佳论文奖7篇(两篇未公开)、最佳主题论文奖1篇、杰出论文奖35篇。大会还评出了资源论文奖(ResourceAward)3篇、社会影响力奖(
 李飞飞团队提出ReKep,让机器人具备空间智能,还能整合GPT-4o
Sep 03, 2024 pm 05:18 PM
李飞飞团队提出ReKep,让机器人具备空间智能,还能整合GPT-4o
Sep 03, 2024 pm 05:18 PM
视觉与机器人学习的深度融合。当两只机器手丝滑地互相合作叠衣服、倒茶、将鞋子打包时,加上最近老上头条的1X人形机器人NEO,你可能会产生一种感觉:我们似乎开始进入机器人时代了。事实上,这些丝滑动作正是先进机器人技术+精妙框架设计+多模态大模型的产物。我们知道,有用的机器人往往需要与环境进行复杂精妙的交互,而环境则可被表示成空间域和时间域上的约束。举个例子,如果要让机器人倒茶,那么机器人首先需要抓住茶壶手柄并使之保持直立,不泼洒出茶水,然后平稳移动,一直到让壶口与杯口对齐,之后以一定角度倾斜茶壶。这
 分布式人工智能盛会DAI 2024征稿:Agent Day,强化学习之父Richard Sutton将出席!颜水成、Sergey Levine以及DeepMind科学家将做主旨报告
Aug 22, 2024 pm 08:02 PM
分布式人工智能盛会DAI 2024征稿:Agent Day,强化学习之父Richard Sutton将出席!颜水成、Sergey Levine以及DeepMind科学家将做主旨报告
Aug 22, 2024 pm 08:02 PM
会议简介随着科技的飞速发展,人工智能已经成为了推动社会进步的重要力量。在这个时代,我们有幸见证并参与到分布式人工智能(DistributedArtificialIntelligence,DAI)的创新与应用中。分布式人工智能是人工智能领域的重要分支,这几年引起了越来越多的关注。基于大型语言模型(LLM)的智能体(Agent)异军突起,通过结合大模型的强大语言理解和生成能力,展现出了在自然语言交互、知识推理、任务规划等方面的巨大潜力。AIAgent正在接棒大语言模型,成为当前AI圈的热点话题。Au
 鸿蒙智行享界S9及全场景新品发布会,多款重磅新品齐发
Aug 08, 2024 am 07:02 AM
鸿蒙智行享界S9及全场景新品发布会,多款重磅新品齐发
Aug 08, 2024 am 07:02 AM
今天下午,鸿蒙智行正式迎来了新品牌与新车。 8月6日,华为举行鸿蒙智行享界S9及华为全场景新品发布会,带来了全景智慧旗舰轿车享界S9、问界新M7Pro和华为novaFlip、MatePadPro12.2英寸、全新MatePadAir、华为毕升激光打印机X1系列、FreeBuds6i、WATCHFIT3和智慧屏S5Pro等多款全场景智慧新品,从智慧出行、智慧办公到智能穿戴,华为全场景智慧生态持续构建,为消费者带来万物互联的智慧体验。鸿蒙智行:深度赋能,推动智能汽车产业升级华为联合中国汽车产业伙伴,为